 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Токсоплазмоз нервной системы
|
|
Токсоплазмоз — заболевание, вызываемое простейшим Toxoplasma gondii ("класса Sporosoa) и приводящее к тяжелому поражению нервной системы И внутренних органов.
Эпидемиология. Токсоплазмоз распространен во многих странах. Человек заражается от домашних животных, чаще всего от кошек которые являются окончательным хозяином паразита. Больные токсоплаэмо-зом животные выделяют паразитов с мочой, слюной, молоком. Человек является промежуточным хозяином. Заражение происходит алиментарным (наиболее часто), капельным, контаминационным (через поврежденные кожу и слизистые оболочки), трансмиссивным (при укусе членистоногих) путем. Возможно внутриутробное заражение при проникновении паразита от матери к плоду через плаценту.
Патогенез. В организме человека токсоплазмы могут размножаться в кишечнике, распространяются лимфогенным и гематогенным путями. Стадия нахождения паразита в крови короткая (несколько дней). Попадая во внутренние органы, токсоплазмы вызывают в них воспалительные явления. Особенно часто поражаются ЦНС, сетчатка глаза, печень, миокард. В этих органах токсоплазмы находятся внутриклеточно и экстрацеллюляр-но. Скопления паразитов называются псевдоцистами. Токсоплазмы способны образовать цисты в тканях, вызывая состояние латентной инфекции. Активизация паразита происходит при неблагоприятных для макроорганизма условиях и снижении его иммунитета. В патогенезе токсоплазмозного поражения ЦНС имеют значение очаговые воспалительные явления, цир-куляторные нарушения, связанные с васкулитом сосудов мозга, обструкция ликворных путей, приводящая к гидро- и микроцефалии.
Патоморфология. Наиболее грубые морфологические изменения ЦНС наблюдаются у детей. При макроскопическом исследовании выявляется расширение желудочков с перивентрикулярной зоной некроза. Обнаруживаются рубцы, замещающие участки некроза, облитерация межжелудочкового отверстия и латеральной апертуры IV желудочка. Выраженная гидроцефалия может привести к атрофии и деформации вещества полушарий мозга.
Морфологические проявления церебрального токсоплазмоза у взрослых многообразны. При микроскопическом исследовании наиболее характерны рассеянные по всему головному и спинному мозгу милиарные гранулемы состоящие из больших эпителиоидных клеток, лимфоцитов, моноцитов, иногда эозинофилов. Гранулемы содержат многочисленных паразитов, окружены зоной отека с некротическими очажками, обусловленными васкулитом. Для токсоплазмоза типично обызвествление мелких очагов. При наличии токсоплазм в субарахноидальном пространстве возникает се-
| от т до |
Р03НК лТнТч^ГкЛиГпМрНо яТл е я и я. Токсоялазмозом заболевают лица любого возраста, однако наиболее часто - дети. Выделяют приобре-тенный и врожденный токсоплазмоз.
| , особом |
Приобретенный токсоплазмоз. Инкубационный 10 дней, продромальный - с общим недомоганием ными болями - обычно несколько недель, иной заболевания проявляется повышением патией. Появляется п щая только на
щими признаками ин
жения различных органов: миокардит^
| ра_ |
кий нефрит, гепатит. Поражение ЦНС
литом, менингоэнцефалитом, энцефаломиелитом.
дикл'лоневротическая и малосимптомная формы (последняя может быть обнаружена лишь с помощью серологических реакций).
Наиболее типичной формой токсоплазмоза ЦНС является менингоэн- цефаяит, в клинической картине которого имеются общемозговые и ме-нингеальные симптомы, парезы и параличи конечностей, тонико-клони-ческие судороги, глазодвигательные (диплопия) и координаторные нарушения. Характерны расстройства сознания, летаргия, утрата памяти и ориентировки в пространстве. В крови обнаруживаются лейкоцитоз со сдвигом формулы влево, увеличение СОЭ, в цереброспинальной жидкости — лим-фоцитарный плеоцитоз, умеренное увеличение содержания белка.
Врожденный токсоплазмоз. Если мать заболевает токсоплазмозом в первой половине беременности, то плод, как правило, погибает вследствие несовместимых с жизнью пороков развития. При инфицировании матери во второй половине беременности ребенок рождается с тяжелым поражением ЦНС. Острая стадия заболевания протекает внутриутробно, и ребенок рождается с активно текущим менингоэнцефалитом или его последствиями. Неврологические проявления менингоэнцефалита разнообразны: полиморфные эпилептические припадки, клонико-тонические судороги, спастические параличи и парезы, тремор, миоклонии, парезы глазных и мимических мышц, нистагм, мышечные контрактуры, менингеальные явления. Иногда имеются симптомы поражения спинного мозга.
Для врожденного токсоплазмоза характерна триада признаков: гидроцефалия, хориоретинит, интрацеребральные кальцификаты. При гидроцефалии размеры головы увеличиваются, кости черепа истончаются, роднички напряжены. Обычно гидроцефалии сопутствует микрофтальмия. Если гидроцефалия развивается до рождения ребенка, то в родах приходится прибегать к кесареву сечению. Однако во многих случаях увеличение объема головы не обнаруживается и гидроцефалия выявляется только при томографии. Хориоретинит часто бывает двусторонним, фокальным, включающим макулярную область. Возможны также ирит, увеит, катаракта, первичная или вторичная атрофия зрительных нервов. Интрацеребральные кальцификаты диаметром 1—3 см располагаются в коре большого мозга и ба-зальных ганглиях и выявляются рентгенологически.
Дети с врожденным токсоплазмозом отстают в умственном развитии. У них наблюдаются также разнообразные психотические состояния (депрессия, психомоторное возбуждение, галлюцинации, кататония). Иногда у детей с врожденным токсоплазмозом обнаруживаются желтуха, гепатоспле-номегалия. Температура обычно остается нормальной.
Давление цереброспинальной жидкости нормальное. Отмечаются высокое содержание белка и умеренный мононуклеарный плеоцитоз, иногда ксантохромия.
Течение. Ранее считалось, что врожденный токсоплазмоз приводит к смерти в течение первых лет жизни ребенка. В настоящее время возможны стабилизация инфекции и даже полное выздоровление с остаточными явлениями, выраженность которых зависит от степени поражения ЦНС (кальцификаты, хориоретинит, эпилептический синдром, отставание в умственном развитии и др.). У взрослых наряду с острым течением часто отмечается подострое или даже хроническое развитие заболевания. Нередко приобретенный токсоплазмоз, особенно у взрослых, протекает без выраженных в той или иной степени клинических симптомов (инаппарантная форма).
Диагностика. В распознавании токсоплазмоза имеют значение рентгенография черепа и томография (КТ- и МРТ-исследования). Однако наибольшую роль играют серологические исследования: реакция с красителем Айбена—Фельдмана, РСК с токсоплазмозным антигеном, РГА, внутри -кожная проба с токсоплазмином, выявление токсоплазм в церебральной жидкости и тканях, выделение токсоплазм при инокуляции инфекционного материала животным. Диагностическое значение имеют только значительно повышенные титры серологических реакций или их нарастание, так как в популяции очень часто выявляются положительные пробы на токсоплазмоз вследствие перенесенной асимптомной формы.
Дифференцировать токсоплазмоз следует от вирусных энцефалитов, энцефаломиелита, менингита. Диагноз обязательно должен быть подтвержден лабораторными данными.
Лечение. Наилучший эффект дает комплексное назначение хлори-дина и сульфадимезина. Суточная доза хлоридина для взрослых 0,05 г, сульфадимезина — 1,5 г. Препараты применяют 2—3 раза в день. Лечение продолжается 5 или 10 дней. После 7—10-дневного перерыва лечение повторяют дважды. Для профилактики токсического влияния хлоридина назначают фолиевую кислоту (0,005 г ежедневно). При необходимости показаны симптоматические средства.
11.8. Неврологические проявления ВИЧ-инфекции (нейроСПИД)
Инфицирование вирусом иммунодефицита человека (ВИЧ-инфекция) может протекать в виде латентного вирусоносительства и в виде синдрома приобретенного иммунодефицита (СПИД), являющегося конечной стадией ВИЧ-инфекции. ВИЧ-инфекция, как правило, сопровождается разнообразной неврологической симптоматикой. Выделяют две группы неврологических проявлений, связанных с ВИЧ-инфекцией. Первая группа - следствие непосредственного, прямого поражения ЦНС и периферической нервной системы ретровирусом. Вторая группа включает т состояния, являющиеся следствием иммунодефицита, ^то ческие (вторичные или параллельные) инфекции с поражек ной и периферической нервной системы, саркома Капоши с
ВО
Франции (в институте Л. Пастера) и в США (в лаборатории; Р^)
Этот вирус из группы регровирусов обладает очен в^^сокои варИабельнос_
тью. В настоящее время описано несколько основах типов
стве генетического материала вируссодержи^™^ к^ J ноп,
ивается в геномный материал клетки человмис пом щ ожа.
вирусного фермента - ««P^^Xe^mH под влиянием вируса
ется в клетке, некоторые инфицированные ^eiiк способен дол-
сливаются, становясь гигантскими и мноГО^£^£ „е оказывая при
гое время циркулировать в крови человека ъ его ^™ внивается сПИД,
этом патогенного действия. Не у всех "^ь, поддержания этого ла-
хотя все они составляют группу риска. Механизмы пода j v ясны
тентного периода, как и причины 1^^^^^ныс внешние Предполагается, что решающее значение имеют дочад
факторы, в том числе и другие инфекции, которые вызывают срыв компен- саггорНЫХ механизмов латентного вирусоносительства. Большое значение имеет состояние иммунной системы в целом, что связано как с предшествующими токсическими и инфекционными воздействиями на данный организм, так и с генетическими особенностями функционирования иммунитета данного человека.
ВИЧ нестоек во внешней среде. Пока доказанными являются четыре основных способа заражения. Первый — половым путем. Этот путь инфицирования, особенно при гомосексуальных контактах, преобладал на ранних этапах развития пандемии и связан во многом с микротравмами слизистых оболочек. Все большее значение приобретает заражение при гетеросексуальных контактах. В настоящее время основной (второй) путь заражения — повторное использование загрязненных инфицированной кровью медицинских инструментов, что происходит чаще всего при многократном использовании наркоманами игл и шприцев. Возможно заражение медицинского персонала при случайных уколах загрязненными медицинскими инструментами. Описаны случаи передачи вируса во время случайных порезов в парикмахерской, при плохом контроле за обработкой инструментов в стоматологических кабинетах. Третий путь передачи — через препараты крови и ее компонентов — имел значение исключительно на ранних этапах развития пандемии. В конце 80-х годов во всем мире установлен обязательный контроль всех препаратов крови для выявления вирусного материала, поэтому этот путь передачи практически потерял значение. Четвертый п\ть — передача ВИЧ от инфицированной матери к ребенку, вероятнее всего, трансплацентарно — большого эпидемиологического значения не имеет. Наличие других путей передачи ВИЧ от одного человека другому пока не доказано. Инкубационный период при этом инфекционном заболевании определить трудно.
ВИЧ тропен к клеткам иммунной и нервной систем. Вирус направленно поражает клетки, имеющие на своей мембране молекулу CD4-peuen~ тора. Среди клеток иммунной системы этот рецептор имеют в основном Т-лимфоциты, выполняющие функции хелперных клеток. В меньшей сте- л этот белок представлен на мембранах других клеток, в частности клеток нервной системы, особенно микроглии, клеток сосудистой стенки и др. ВИЧ связывается с CD4-peuenTopoM клетки при участии своего поверхностного белка, который в последующем может экспрессироваться на поверхности инфицированной клетки.
Патогенез. Поражение иммунной системы при ВИЧ-инфекции о не только с прямым или непрямым (при участии иммунных механизмов) цитотоксическим влиянием вируса на Т-хелперные клетки, но и нарушением регуляции иммунного ответа. Т-лимфоциты-хелперы осуществляют координацию и стимуляцию пролиферации и дифференцировки всех клеток иммунной системы, стимулируют продукцию антител В-клет-ками, продуцируют различные цитокины, координирующие работу иммунной системы. Недостаток и/или изменения активности хелперов приводят к нарушению иммунного ответа на многие вирусы, бактерии, простейшие, многие из которых при отсутствии иммунодефицита имеют условно-пато-
ое значение. Дисрегуляция в работе иммунной системы проявляется и что наряду с иммунодефицитом у больных СПИДом отмечаются аутоиммунные реакции, т.е. неконтролируемые реакции на собственные анти-Некоторые неврологические проявления СПИДа также связаны с ау-
тоиммунными реакциями, например полиневропатия и асептический менингит.
Непосредственное воздействие вируса на нервную ткань является следствием биохимических изменений в пораженных клетках и развитием аутоиммунных реакций на антигены мозга. Причиной развития неврологической симптоматики является как прямой цитопатический эффект, так и нарушения взаимодействия между клетками нервной системы по типу дисбаланса в иммунной системе.
Среди оппортунистических инфекций наиболее часто наблюдается поражение мозга цитомегаловирусами, вирусами группы herpes, токсоплаэ-мой, гистоплазмой, грибами. Многие заболевания, например первичная лимфома ЦНС или криптококковый менингит, наблюдаются только у больных СПИДом. Некоторые заболевания развиваются при одновременном инфицировании мозга ВИЧ и другими инфекционными агентами, например прогрессирующая мультифокальная лейкоэнцефалопатия связана с одновременным воздействием ВИЧ и JC-вируса, а саркома Капоши, вероятно, развивается при одновременном воздействии на эндотелий сосудов ВИЧ и вируса Эпштейна—Барра.
11.8.1. Первичное поражение нервной системы при ВИЧ-инфекции
Патоморфология. Морфологически прямое поражение ВИЧ мозга приводит к развитию подострого гигантоклеточного энцефалита с участками демиелинизации. В ткани мозга могут быть выявлены моноциты с большим количеством вируса, проникшие из периферической крови. Эти клетки могут сливаться, образуя гигантские многоядерные образования с огромным количеством вирусного материала, что и явилось причиной обозначения этого энцефалита как гигантоклеточного. В то же время характерным является несоответствие тяжести клинических проявлений и степени патоморфологических изменений. У многих больных с отчетливыми клиническими проявлениями ВИЧ-ассоциированной деменции патоморфоло-гически может выявляться только «побледнение» миелина и слабо выра-
™л ГнНиТеЬ"к?еТрГоИя°в л е н и я. Симптомы прямого (первичного) поражения нервной системы при ВИЧ-инфекции классифицируются в
| ас- по- стра- |
комплекс нарушений, обозначаемый ранее как С^
включают три ^^^^ ^^^
социированную миелопатию
знавательно-двигательные Расстройс™кные с этими расстройствами
дают прежде всего от нарушении п03™^7^ больных наблюдаются го типа, которое
-»■■
24-
тия, ограничение мотиваций. В редких случаях болезнь может проявляться аффективными расстройствами (психозом) или припадками. При неврологическом осмотре этих больных выявляются тремор, замедление быстрых, повторяющихся движений, пошатывание, атаксия, гипертонус мышц, генерализованная гиперрефлексия, симптомы орального автоматизма. В начальных стадиях слабоумие выявляется только при неиропсихологическом тестировании. В последующем деменция может быстро прогрессировать до тяжелого состояния. Данная клиническая картина наблюдается у 8—16 % больных СПИДом, однако при учете данных аутопсии этот уровень повышается до 66 %. В 3,3 % случаев деменция может являться первым симптомом ВИЧ-инфекции.
ВИЧ-ассоциированная миелопатия. При этой патологии преобладают двигательные расстройства, преимущественно в нижних конечностях, связанные с поражением спинного мозга (вакуольная миелопатия). Отмечается значительное снижение силы в ногах, повышение мышечного тонуса по спастическому типу, атаксия. Часто выявляются и расстройства познавательной деятельности, однако слабость в ногах и нарушения походки выступают на первый план. Двигательные расстройства могут затрагивать не только нижние, но и верхние конечности. Возможны нарушения чувствительности по проводниковому типу. Миелопатия носит скорее диффузный, чем сегментарный характер, поэтому, как правило, не отмечается «уровня» двигательных и чувствительных расстройств. Характерно отсутствие болей. В цереброспинальной жидкости отмечаются неспецифические изменения в виде плеоцитоэа, повышение содержания общего белка, возможно выявление ВИЧ. Распространение миелопатии среди больных СПИДом достигает 20 %.
ВИЧ-ассоциированные минимальные познавательно-двигательные расстройства. Этот сиидромокомплекс включает наименее выраженные нарушения. Характерные клинические симптомы и изменения нейропсихоло-гических тестов аналогичны таковым при деменции, но в гораздо меньшей степени. Часто наблюдается забывчивость, замедление мыслительных процессов, снижение способности концентрировать внимание, нарушение походки, иногда неловкость в руках, изменения личности с ограничением мотивации.
Диагностика. В начальных стадиях заболевания деменция выявляется только с помощью специальных нейропсихологических тестов. В последующем типичная клиническая картина на фоне иммунодефицита, как правило, позволяет точно поставить диагноз. При дополнительном исследовании отмечаются симптомы подострого энцефалита. При КТ- и МРТ-исследовании выявляют атрофию мозга с увеличением борозд и желудочков. На МРТ можно отметить дополнительные очаги усиления сигнала в белом веществе мозга, связанные с локальной демиелинизацией. Данные исследования цереброспинальной жидкости неспецифичны, могут выявляться небольшой плеоцитоз, незначительное повышение содержания белка, повышение уровня иммуноглобулинов класса G.
Другие поражения ЦНС, связанные с ВИЧ-инфекцией. У детей первичное поражение ЦНС часто является наиболее ранним симптомом ВИЧ-инфекции и обозначается как прогрессирующая ВИЧ-ассоциированная энцефалопатия детей. Для этого заболевания характерны задержка развития, мышечная гипертония, микроцефалия и калъцификация базальных ганглиев.
Практически у всех ВИЧ-инфицированных в той или иной степени можно выявить симптомы острого асептического менингита, который возникает сразу после инфицирования и патогенетически скорее всего связан с аутоиммунными реакциями при первичном ответе на антигены вируса. Этот серозный менингит проявляется симптомами острого воспаления оболочек (умеренно выраженный общемозговой и менингеальный синдромы), иногда с поражением черепных нервов. Клинические проявления обычно регрессируют самостоятельно в течение 1—4 нед.
ВИЧ-ассоциированные симптомы поражения периферической нервной системы. У больных СПИДом часто наблюдаются воспалительные поли-нейропатии в виде подострой мультифокальной множественной полиневропатии или множественных невритов с преимущественным поражением нижних конечностей. В этиологии этих нарушений, помимо ВИЧ, возможна роль вирусов рода Herpesvirus. Реже встречаются тяжелая форма подострой сенсомоторной полиневропатии или быстро развивающиеся периферические параличи при преимущественно моторных полиневропатиях. Наиболее часто ВИЧ-инфекция сопровождается дистальными полиневропатиями с преобладанием чувствительных нарушений в виде парестезии и дизестезий преимущественно в области свода стопы и пальцев ног, иногда с легкой слабостью и снижением коленных рефлексов.
ВИЧ-инфекция иногда сопровождается миопатическим синдромом. Для этого синдрома характерно подострое развитие проксимальной мышечной слабости с миалгиями, повышением утомляемости мышц и увеличением уровня креатинкиназы в сыворотке. Изменения ЭМГ близки к наблюдаемым при полиомиозитах, а при биопсии мышц выявляется де- и регенерация миофибрилл, периваскулярное и интерстициальное воспаление.
Лечение. Стратегия профилактики и лечения предусматривает борьбу с самой ВИЧ-инфекцией, симптоматическое лечение при поражении нервной системы, лечение оппортунистических инфекций и заболеваний, консультирование, санитарно-просветительную работу. Специфическое лечение включает противовирусную и иммунотерапию.
Проведены клинические испытания более 30 препаратов с противовирусным действием для лечения ВИЧ-инфекции. Наиболее известен ретро-вир (зидовудин, AZT, азидотимидин), дающий доказанный виростатичес-кий эффект. Ретровир является конкурентным ингибитором обратной транскриптазы, отвечающей за образование провирусной ДНК на матрице ретровирусной РНК. Активная трифосфатная форма ретровира, являясь структурным аналогом тимидина, конкурирует с эквивалентным производным тимидина за связывание с ферментом. Эта форма ретровира не имеет необходимых для синтеза ДНК З'-ОН группировок. Таким образом, цепь провирусной ДНК не может наращиваться, Конкуренция ретровира с обратной транскриптазой ВИЧ примерно в 100 раз больше, чем с альфа-поли-меразой клеточной ДНК человека. Критерием для назначения азидотими-дина является снижение уровня Т-хелперов ниже 250—500 на 1 мм3 или появление вируса в крови. Препарат используется для лечения больных СПИДом во всех стадиях, показано его благоприятное влияние на больных с ВИЧ-ассоциированным познавательно-двигательным комплексом, включая СПИД-деменцию и миелопатию, а также с ВИЧ-ассоциированными полиневропатиями, миопатиями. Ретровир используется для профилактики развития неврологических проявлений ВИЧ-инфекции и оппортунистических процессов. Препарат проникает через ГЭБ, его уровень цереброспи-

 накьной жидкости составляет около 50 % от уровня в плазме. В качестве ьной дозы для больных с массой тела около 70 кг рекомендуется принимать по 200 мг каждые 4 ч (1200 мг в день). В зависимости от клиничес- состояния больных и лабораторных показателей дозировки могут варьировать от 500 до 1500 мг в день. Необходимость в подборе индивидуальных доз может возникать у больных с проявлениями побочных эффектов иди при тяжелых проявлениях СПИДа с истощением ресурсов костного мозга, что проявляется лейкопенией и анемией. Для уменьшения выраженности гематоксических эффектов препарат часто сочетают с эритро- или гемопоэтином, витамином В,2. Среди других возможных побочных эффектов следует отметить анорексию, астению, тошноту, поносы, головокружения, головную боль, лихорадку, нарушения сна, извращения вкуса, сыпь, снижение психической активности, появление чувства тревоги, учащение мочеиспускания, генерализованные боли, озноб, кашель, одышку. Убедительных данных об особенностях острой передозировки пока нет, при проявлении побочных эффектов при длительном приеме может быть полезен гемодиализ. В настоящее время ретровир остается единственным формально разрешенным противовирусным препаратом для лечения СПИДа, в том числе первичных поражений нервной системы. Учитывая большое количество тяжелых побочных эффектов ретровира, в настоящее время ведутся клинические испытания других нуклеозидных производных, у которых ми-елотоксическое действие выражено слабее.
накьной жидкости составляет около 50 % от уровня в плазме. В качестве ьной дозы для больных с массой тела около 70 кг рекомендуется принимать по 200 мг каждые 4 ч (1200 мг в день). В зависимости от клиничес- состояния больных и лабораторных показателей дозировки могут варьировать от 500 до 1500 мг в день. Необходимость в подборе индивидуальных доз может возникать у больных с проявлениями побочных эффектов иди при тяжелых проявлениях СПИДа с истощением ресурсов костного мозга, что проявляется лейкопенией и анемией. Для уменьшения выраженности гематоксических эффектов препарат часто сочетают с эритро- или гемопоэтином, витамином В,2. Среди других возможных побочных эффектов следует отметить анорексию, астению, тошноту, поносы, головокружения, головную боль, лихорадку, нарушения сна, извращения вкуса, сыпь, снижение психической активности, появление чувства тревоги, учащение мочеиспускания, генерализованные боли, озноб, кашель, одышку. Убедительных данных об особенностях острой передозировки пока нет, при проявлении побочных эффектов при длительном приеме может быть полезен гемодиализ. В настоящее время ретровир остается единственным формально разрешенным противовирусным препаратом для лечения СПИДа, в том числе первичных поражений нервной системы. Учитывая большое количество тяжелых побочных эффектов ретровира, в настоящее время ведутся клинические испытания других нуклеозидных производных, у которых ми-елотоксическое действие выражено слабее.
Учитывая роль аутоиммунных реакций в развитии поражений периферической нервной системы при СПИДе, для лечения в некоторых случаях эффективны кортикостероиды и цитостатики, плазмаферез. Для коррекции иммунодефицита используют различные иммуностимуляторы. Среди них шггокины (альфа- и бета-интерфероны, интерлейкины и др.), иммуноглобулины, гемопоэтические факторы роста. Восстановительная иммунотерапия до последнего времени не давала значительных клинических эффектов, позволяя только несколько затормозить развитие патологического процесса. В последние годы редко осуществляют пересадку костного мозга из-за большого количества побочных реакций и незначительной эффективности этой процедуры. Исследуется использование факторов тимуса, растворимого рекомбинантного рецептора Т-лимфоцитов CD4, способного предупреждать попадание вируса в клетку, рекомбинантных и высокоочищенных белков оболочки ВИЧ в качестве вакцин.
Прогноз. При наличии неврологических проявлений СПИДа, как правило, неблагоприятный. Пока не известны случаи излечения от ВИЧ-инфекции, хотя возможно многолетнее бессимптомное вирусоносительст-во. Основное значение в борьбе с ВИЧ-инфекцией придается профилактическим мероприятиям, которые уже позволили снизить темпы роста числа инфицированных лиц.
]1-^- Оппортунистические заболевания нервной системы при ВИЧ-инфекции
Наиболее важными из этой группы заболеваний является прогрессирующая
бифокальная энцефалопатия, церебральный токсоплазмоз, криптокок-
скингиты, энцефалиты и полирадикулоневриты, вызванные цито-
•; русом и вирусами рода Herpesvirus, туберкулез с поражением
мозга, первичная лимфома ЦНС. Диагноз оппортунистической инфекции часто верифицируется только ретроспективно при ответе на специфическую терапию, подозрение может возникать при анализе неспецифических клинических симптомов, данных компьютерной и МР-томо-графии и основываться на серологических исследованиях или данных биопсии.
При прогрессирующей мультифокальной лейкоэнцефалопатии отмечаются клинические проявления многоочагового поражения белого вещества головного мозга в виде гемипарезов и гемигипестезий, гемианопсий, статической и динамической атаксии, которые могут сопровождаться снижением интеллекта, припадками. Симптомы медленно неуклонно прогрессируют до полной обездвиженности больных. Причиной этой энцефалопатии является паповавирус JC, действующий одновременно с ВИЧ. Помимо очагов демиелинизации, патогномонично выявление глиальных клеток с характерными включениями вокруг областей разрушения миелина. Эффективного лечения при этом заболевании нет. Прогноз неблагоприятный, так как максимальная продолжительность жизни после появления первых симптомов не превышает 2 мес.
Церебральный токсоплазмоз является следствием реактивации латентной инфекции мозга внутриклеточным паразитом Toxoplasma gondii. Клиническая картина обусловлена локализацией и активностью воспалительного процесса. Специфичных клинических симптомов этого энцефалита нет. При томографии часто отмечаются множественные билатеральные кольцевые очаги, хотя эти изменения также не являются специфичными Точный диагноз может быть поставлен на основе данных о выявлении этого возбудителя различными методами в образцах биопсии. В некоторых случаях диагноз подтверждается косвенно, если состояние больного улучшается после назначения специфических препаратов (пириметамин, суль-фадиазин и др.).
Криптококковые менингиты вызываются грибом Cryptococcus neofor-mans. Этот менингит, как правило, характеризуется выраженным менинге- альным и общемозговым синдромами. Диагноз устанавливается при посеве цереброспинальной жидкости на криптококк. У многих больных это з; болевание является первым проявлением перехода из стадии латентного вирусоносительства в стадию СПИДа. Специфическое лечение (амфотери-цин В) приводит к регрессу симптоматики.
Практически не поддается лечению тяжелая мультифокальная полира-дикулоневропатия, вызываемая цитомегаловирусом. Этот синдром, как правило, сопровождается другими проявлениями инфекции: пневмониями,
колитами, ритинитами и др. mhwwiln
Реактивация латентной инфекции, вызванной Micobactenum tuberculosis, приводит к развитию туберкулезного менингита, абсцессов мозга [яже лые диффузные энцефалиты у больных СПИДом могут быть вызваны виру сами Herpes simplex и Varicella zoster. У 5 % больных СПИДом могут выяв ляться первичная лимфома ЦНС (преимущественно В-типа в. генез^кото рой большое значение имеет инфекция вирусом ^^™*^*™£ZJ£. кома Капоши, иногда приводящая к развитию внугримозговых кровои ний. Первичная лимфома ЦНС - специфичное дп' СПИДа прояв Пролиферируют обычно атипичные лимфоциты. Опухоль ч» «^ГЖ ся периваскулярно, а клиническая картина зависит от локализации ма опухоли.
-.
Течение. Помимо борьбы с непосредственно ретровирусом, проводится специфическое лечение того или иного инфекционного заболевания, развивающегося на фоне иммунодефицита. Активно используются комбинации иммуномодуляторов и противовирусных препаратов. Например, рекомбинантный альфа-интерферон (дозы от 3 000 000 до 54 000 000 ME) самостоятельно или в комбинации с ретровиром или винбластином используют при лечении саркомы Капоши. Среди противовирусных средств "для лечения оппортунистических вирусных инфекций наиболее эффективным считается ацикловир — аналог пуринового нуклеозида, который после превращения в организме человека в трифосфат ацикловира ин- гибирует биосинтез ДНК вируса. Вирусная форма фермента тимидинкина-зы (точка приложения ацикловира) связывается с препаратом в 1 000 000 раз быстрее, чем фермент человека. Чаще используют внутривенные введения: по 5—10 мг/кг через 8 ч 5—10 дней в зависимости от тяжести поражения. Побочные эффекты достаточно выражены, особенно опасна кристал-лурия, наблюдаемая чаще при внутривенном введении, поэтому препарат вводят медленно в течение часа на фоне обильного питья, что следует учитывать при лечении энцефалитов с отеком мозга. Реже используется вида-рабин — аналог пуринового нуклеозида, который ингибирует ДНК-поли-меразу, т.е. этот препарат также эффективен только против ДНК-содержа-щих вирусов. Используется преимущественно внутривенный способ введения в течение 12 ч. При использовании видарабина возможны следующие побочные реакции: паркинсоноподобный тремор, атаксия, миоклонии, галлюцинации и дезориентация, при увеличении дозы возможна панцито-пения. Противовирусные препараты в тяжелых случаях сочетают с плазма-ферезом. В некоторых случаях эффективно сочетание противовирусных препаратов с интерферонами.
При грибковых инфекциях, в частности криптококковых менингитах и гистоплазмозе, чаще используют амфотерицин В. Этот полиеновый антибиотик связывается со специфическим белком мембраны оболочки грибов и простейших, деформируя ее, что приводит к выходу калия и ферментов и соответственно гибели клетки. Чаще используют внутривенно по 0,1 мг в 1 мл 5 % раствора глюкозы, может быть эффективным эндолюмбальное введение. Препарат высокотоксичен, наиболее опасно нарушение функции почек. Поэтому использовать его рекомендуют только при полной уверенности в серологически подтвержденном диагнозе.
При токсоплазмозе ЦНС используют сочетание хлоридина (пиримета-мина) и сульфаниламидов короткого действия (сульфазин, сульфадиазин, сульфадимезин). Эти препараты влияют на обмен фолиевой кислоты, оказывая совместное бактерицидное действие. При туберкулезных поражениях используются обычные дозировки противотуберкулезных препаратов, редпочтение отдается хорошо проникающему через ГЭБ изониазиду (300 мг в день per os), реже используют рифампицин (600 мг в день per os) и стрептомицин (0,75 г внутримышечно 6 раз в день) Лимфома ЦНС поддается агрессивной радиационной терапии, без которой смерть больного мо*ет уступить В течение 2 неД- Медикаментозное лечение больных ней-роСПИДом должно сочетаться с полноценным питанием для поддержания массы тела, вопросы питания должны быть рассмотрены уже при обнаружении позитивной реакции на ВИЧ. Некоторые виды диет с низким содержанием белка могут быть опасны для таких больных так как подавляется
оральный иммунитет.
I
11.9. Боковой амиотрофический склероз
Боковой амиотрофический склероз (БАС) - хроническая прогрессирующая болезнь нервной системы неясной этиологии, избирательно поражающая двигательные нейроны спинного и головного мозга, сочетающаяся с дегенерацией корково-спинномозговых и корково-ядерных волокон Частота заболевания - 2-7 случаев на 100 000 жителей. Средний возраст больного при начале заболевания составляет 50-70 лет, редко менее 40 лет. При семейных формах (5—10 %) случаев отмечается наследование по аутосомно-доминантному типу.
Патогенез. Наиболее обоснованной в настоящее время считается мультифакториальная теория — воздействие внешних патологических факторов (экзотоксины, неизвестные инфекционные агенты) на предрасположенных лиц. Показано, что при некоторых формах БАС причиной гибели мотонейронов служат продукты свободнорадикального окисления и глута-матергическая экзотоксичность. Избирательность поражения мотонейронов и нарастание темпа их гибели еще не получили удовлетворительного объяснения.
Патоморфология. Отмечена дегенерация нейронов в III и V слоях прецентральной извилины, прилегающих отделах лобной доли, в передних рогах спинного мозга, в двигательных ядрах V, VII, X, XII черепных нервов в стволе мозга. Поражаются кортико-спинальные пути на всем их протяжении. Больше всего страдают передние рога и боковые канатики спинного мозга.
| бость в дистальных од рофиями мышц, появляется неустойчивость, нетвердость пр степпаж (петушиная походка). При бульварной форм* |
| под- |
Клинические проявления. Заболевание характеризуется сочетанием синдрома поражения передних рогов спинного мозга и пирамидного синдрома при отсутствии объективных чувствительных расстройств и нарушения функции тазовых органов. В начале заболевания появляются мышечные атрофии дистальных отделов конечностей, предшествующие, как правило, снижению мышечной силы. Фасцикуляции, фибрилляции и крампи могут быть наиболее ранними симптомами заболевания. Параллельно симптомам периферического паралича выявляются признаки пирамидного синдрома: высокие сухожильные и периостальные рефлексы, расширение их рефлексогенных зон, патологические рефлексы Бабинско-го, Бехтерева. Мышечный тонус в паретичных конечностях повышен по спастическому типу. Симптомы периферического и центрального паралича могут быть выражены равномерно; в части случаев, симптомы периферического поражения превалируют над проявлениями центрального; возможно и обратное сочетание. В поздних стадиях заболевания доминируют признаки периферического паралича. В начальной стадии БАС в зависимости от преимущественной локализации патологического процесса выделяют шейно-грудную, пояснично-крестцовую, бульбарную формы, аяш формы БАС, ассоциированные с деменцией или, что P^c мндным синдромом. При шейно-грудной форме поражаются мышцы тальных отделов верхних конечностей - атрофии ™™™^j яньей лапы». Атрофии и парезы верхних конечностей вают мышцы плечевого пояса, спины, грудной клетки. сохранены длительно. При пояснинно-крестцовои форме БАС бость в дистальных отделах нижних конечностей, с ФасцикУ
| нее присоединяется |
й етвер

| Глава 12 |
типичны фибриллярные подергивания и атрофии языка, расстройства глотания артикуляции, фонации. Движения языка ограничены, голос приобретает гнусавый оттенок, больные поперхиваются при еде, голова часто свисает движения ее ограничены, лицо становится амимичным, нижняя челюсть отвисает жевание затруднено. Часто присоединяются псевдобуль- барные симптомы в виде рефлексов орального автоматизма, насильственного плача, смеха.
Течение. Для заболевания характерно прогредиентное течение. Процесс неуклонно распространяется и приводит к летальному исходу на фоне бульбарных расстройств. Продолжительность жизни больных в зависимости от формы заболевания составляет от 2 до 12 лет, в среднем 3—4 года.
Диагностика и дифференциальный диагноз. На электромиограмме отмечают ритмичные потенциалы фасцикуляций с амплитудой до 300 мкВ и частотой 5—35 Гц (ритм «частокола»), скорость про-веления не изменена, нет «блоков проведения». Цереброспинальная жидкость, как правило, не изменена. МРТ нормальна. Для постановки диагноза БАС необходимым является сочетание симптомов центрального и периферического паралича на уровне шейно-грудного, пояснично-крестцового утолщений спинного мозга и(или) бульбарного отдела ствола мозга. Диагноз определяется как возможный — при поражении одного отдела из трех, как вероятный — при поражении двух, как достоверный, если поражены все три отдела.
Боковой амиотрофический склероз необходимо дифференцировать от сирингомиелии, при которой выявляют изолированное сегментарное поражение поверхностной чувствительности. Опухоли спинного мозга, кранио-вертебральной области выявляются при компьютерной и МР-томографии. При спондилогенной шейной миелопатии наблюдаются нарушения глубокой чувствительности. Сходная с БАС клиническая картина встречается при полиневропатии с «блоками» проведения, гиперпаратиреозе, тиреотоксикозе, полимиозите, глиоме ствола, полиомиелите. Иногда встречается синдром доброкачественных фасцикуляций (миокимии) у молодых людей при отсутствии какой-либо другой неврологической симптоматики.
Лечение. Эффективного лечения не существует. Основой является:имптоматическая терапия. Депрессия наблюдается часто и снимается транквилизаторами или трициклическими антидепрессантами, уменьшающими также саливацию. Нарушения сна корректируют бензодиазепинами. При болезненных мышечных сокращениях (крампи) назначают финлеп-син, миорелаксанты. При спастичности применяют миорелаксанты (лиоре-ал, мидокалм). Боли, часто суставные, могут быть купированы нестероидными противовоспалительными препаратами. В терминальной стадии применяют опиаты.
Бронхолегочная инфекция, часто протекающая асимптомно, требует применения антибиотиков широкого спектра действия.
Саливацию могут уменьшить препараты атропина.
Применяют специальные приспособления для облегчения движений (трости, кресла, функциональные кровати), воротники для фиксации шеи.
выраженных нарушениях бульбарных функций целесообразно применение назогастрального зонда или наложение гастростомы. Вопрос
усственной вентиляции легких решается в каждом случае индивидуально.
ДЕМИЕЛИНИЗИРУЮЩИЕ ЗАБОЛЕВАНИЯ
12.1. Рассеянный склероз
Рассеянный склероз (син.: множественный склероз, sclerosis disseminata) -хроническое демиелинизирующее заболевание, развивающееся вследствие воздействия внешнего патологического фактора (наиболее вероятно ин-фекционного) на генетически предрасположенный организм. При этом заболевании наблюдается многоочаговое поражение белого вещества центральной нервной системы, в редких случаях с вовлечением и периферической нервной системы. В большинстве случаев рассеянный склероз (PC) характеризуется неуклонным, чаще волнообразным течением, которое в последующем может сменяться постепенным прогрессированием.
Эпидемиология. Исторически более высокие показатели распространенности (болезненности) и заболеваемости PC встречаются в географических зонах, максимально удаленных от экватора. В последние годы эта зависимость выражена в меньшей, степени, и рассеянный склероз стал часто встречаться и во многих южных регионах. Прямая связь распространенности PC с широтой, вероятнее всего, обусловлена не только географическим положением, но и большим количеством этнических социально-экономических особенностей.
В зависимости от показателей распространенности PC выделяют три
зоны: зона высокого риска с частотой заболевания более 50 на 100 000 на
селения включает Северную и Центральную Европу, юг Канады и север
США, юг Австралии и Новую Зеландию. Зона среднего риска имеет час
тоту заболевания 10—50 на 100 000 населения и объединяет центр и юг
США, Гавайские острова, северную Скандинавию, Южную Европу, Из
раиль, белое население Южной Африки, север и запад Украины, евро
пейскую часть России, Дальний Восток. Зона низкого риска с частотой 10
и менее на 100 000 населения включает Азию, север Южной Америки,
Аляску, Гренландию, острова Карибского моря, Мексику, большую часть
Африки Ближний и Средний Восток. Основной тенденцией в эпиде
миологии PC последних десятилетий является отчетливое увеличение
показателей распространенности и заболеваемости в большинстве регио
нов. Dr.
В России помимо исторически сложившихся зон высокого риска v на севере и северо-западе страны, в 80-е годы описаны зоны высокого риска PC на юге европейской части, в Поволжье и на Дальнем Востоке.
Особенностью географического распространения PC является наличи небольших территорий с очень высоким уровнем заболеваемости (кластеры) и единичных случаев резкого повышения показателей заболеваемос и (микроэпидемий PC), среди которых наиболее известна эпидемия Р Фарерских островах (Дания) после второй мировой воины.
 Помимо географических, существенное влияние на риск развития Рс оказывают особенности питания, социально-экономические и экологические характеристики. Обращается внимание на возрастные и половые различия PC редко диагностируется у пациентов моложе 15 и старше 55 лет, хотя в последние годы отмечается увеличение случаев раннего дебюта заболевания в возрасте до 15 лет (10-12 лет), что составляет 2-8 % от общего числа больных PC в различных регионах.
Помимо географических, существенное влияние на риск развития Рс оказывают особенности питания, социально-экономические и экологические характеристики. Обращается внимание на возрастные и половые различия PC редко диагностируется у пациентов моложе 15 и старше 55 лет, хотя в последние годы отмечается увеличение случаев раннего дебюта заболевания в возрасте до 15 лет (10-12 лет), что составляет 2-8 % от общего числа больных PC в различных регионах.
Этиология. В настоящее время PC определяют как мультифакто-риальное заболевание. Под этим понимается участие как внешних, так и наследственных факторов.
Внешние факторы, воздействуя на генетически предрасположенных лиц, могут стимулировать развитие воспалительно-аутоиммунного процесса в ЦНС и разрушение миелина. Наибольшее значение, вероятно, имеют инфекционные агенты, особенно вирусные инфекции. Многочисленные исследования показали, что, вероятнее всего, нет одного вируса как первопричины PC. При этом заболевании выявлен повышенный титр антител в сыворотке и цереброспинальной жидкости к различным вирусам, что может быть следствием нарушения иммунорегуляции (поликлональная активация гуморального иммунитета), а не указывать на этиологическое значение того или иного возбудителя.
Вирусы кори, краснухи, инфекционного мононуклеоза (вирус Эпштей-на—Барра), вирус герпеса, а также различные бактерии могут выступать в качестве триггерного фактора, участвуя в индукции и поддержании воспалительного и аутоиммунного процессов. Большое внимание уделяется участию латентной, персистирующей вирусной инфекции, в том числе и условно-патогенных для человека вирусов, в стимуляции иммунной системы и реактивации патологического процесса. В качестве триггеров обострений PC могут выступать и различные экзо- и эндогенные факторы, влияющие на проницаемость гематоэнцефалического барьера (ГЭБ), отделяющего антигены мозга как забарьерного органа от иммунной системы крови. Среди этих факторов особое значение могут иметь травмы головы и спины, стрессы, физическое и психическое перенапряжение, операции. Предполагается, что большое влияние на иммунологические и биохимические процессы в ЦНС имеют особенности питания, в частности преобладание животных жиров и белков может быть одним из дополнительных факторов риска развития PC. He исключается дополнительное патологическое влияние экзотоксинов, в частности красок, органических растворителей, продуктов нефтепереработки.
Убедительно доказано наличие генетических факторов предрасположенности к рассеянному склерозу, что наиболее отчетливо проявляется при семейных случаях заболевания. В семьях больных риск второго случая заболевания в разных этнических группах в 4-20 раз выше чем в данной популяции в целом. У монозиготных близнецов PC встречается в 4 раза чаще, чем у дизиготных. Эпидемиологические и генетические исследования выявили связь между риском развития PC и определенными локусами лавной системы гистосовместимости на 6-й хромосоме (HLA-системы), обусловливающими своеобразие иммунного ответа у данного индивидуума. Первоначальные исследования косвенными методами выявили связь с ло-7 из первого класса. Более сильная ассоциация отмечена с аллелей по локусу HLA второго класса, который наследуется сцел-ieHHo. Этот набор получил название «гаплотип DR2» (или Dw2). Исследования с использованием методов прямого генотипирования позволили
уточнить его аллельный состав, который в настоящее время описан как DRB14501, DQA1-0102, DQBrO602. Помимо этого гаплотипа единственной подтвержденной ассоциацией является связь PC с DR4 у жителей о.Сардиния (Италия). Помимо ассоциаций с генами HLA-системы исследуются возможные связи риска развития PC с генами цитокинов, белков миелина, неспецифических ферментов, Т-клеточных рецепторов, иммуноглобулинов и др. Вероятнее всего, PC - мультигенное заболевание, для развития которого необходима комбинация определенных аллелей по нескольким генам. Под воздействием внешних факторов эта наследственная предрасположенность реализуется как хронический демиелинизирующий процесс, активность и своеобразие клинических проявлений которого также зависят от индивидуального набора внешних и генетических факторов.
Патогенез. Большое значение в патогенезе PC имеет состояние иммунной системы. Об этом свидетельствуют гистологические исследования: наличие инфильтратов, состоящих из иммунокомпетентных клеток, в свежей бляшке; связь с генетическими факторами, контролирующими иммунную систему; разнообразные изменения показателей иммунологических реакций крови и цереброспинальной жидкости; способность иммуно-супрессоров подавлять обострение заболевания и, наконец, наличие антител и клонов клеток, специфичных к антигенам мозга, среди которых наиболее энцефалитогенным является основной белок миелина (ОБМ). Небольшая группа активированных клеток вызывает повышение проницаемости гематоэнцефалического барьера, что приводит к проникновению в ткань мозга большого количества клеток крови и развитию воспалительной реакции. В последующем происходит срыв толерантности к антигенам миелина и в патологический процесс включаются различные клеточные и, в меньшей степени, гуморальные аутоиммунные реакции. Аутоиммунные реакции на ОМБ и другие антигены нарастают лавинообразно. Ведущее значение в запуске и поддержании иммунопатологического процесса имеют антигенпредставляющие клетки — микроглия, астроциты и эндотелий сосудов мозга, способные привлекать циркулирующие лимфоциты в ткань и активировать их. Многие клетки глии, как и клетки крови, способны вырабатывать активационные цитокины, стимулирующие воспалительные и аутоиммунные реакции. Среди активационных цитокинов основное значение имеют гамма-интерферон, фактор некроза опухолей альфа, интерлеикины 1 2и6(ИЛ1 ИЛ2 ИЛ6) способные усиливать экспрессию молекул адгезии и стимулировать представление антигена лимфоцитам. Повышение продукции цитокинов может происходить под воздействием Р«™ч"ьи внешних и внутренних факторов, что реактивирует ^опоп цесс. Непосредственно разрушение миелина может происходить мм способами - активированными клетками, иитокинами J Возможны переключение иммунных реакции с внешних антигены мозга (механизмы молекулярной ^икрии), Р на суперантигены и поликлональная стимуляция иммунитету точности механизмов контроля за аутоиммунными реакциями.
| реоло- |
Не исключена возможность прямого ^^^^ сов, цитокинов, продуктов распада миелина .* других на олигодендроциты (миелинсинуирующие ^™ патогенезе PC имеют особенности обмена в ткани гических свойств крови, как при любом ™п™ цинка, меди, железа и других микроэлементов, обмена
|
| «я» |
| - I -- |

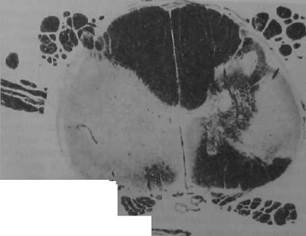
Рис. 12.1. Головной и спинной мозг при рассеянном склерозе
^o^ZTc^nt-lZonZT^T бЛЯШКИ В семи°вальном центре и расширенные
области; кровенаполнение сТула сЛТ^ КЛе™ЧНая ^фильтрация демиелинизированной
низации в спинном мозге У УфТ°Й лим*оци™в и эозинофилов; в - очаги демиели-
окна Joxoo РУ фаКТОрЫ- ПРИ эт°м c™<°t нерв-
ниям Цитокин!, пп ПОДвеРгаются необратимым дегенеративным измене-могут поие^ать'н. УКТЫ пеРекисно™ окисления и другие вещества огут повреждать нервные волокна уже в ранних стадиях заболевания.
Рис. 12.1. Продолжение.
Длительный аутоиммунный процесс приводит к истощению иммунной системы с развитием вторичного иммунодефицита и снижению гормональной активности коры надпочечников.
Патоморфология. Морфологически патологический процесс при PC характеризуется многочисленными очаговыми изменениями в головном и спинном мозге (рис. 12.1). Излюбленная локализация очагов (или бляшек) — перивентрикулярное белое вещество, боковые и задние канатики шейной и грудной части спинного мозга, мозжечок и ствол мозга. В этих отделах ЦНС образуется большое количество очажков разной величины и формы, отличающихся от нормальной нервной ткани цветом и консистенцией. Характерным для свежей бляшки является периваскулярная инфильтрация ткани мозга лимфоидными элементами крови, большинство которых составляют Т-клетки, а также выраженный локальный отек, приводящий в ранних стадиях к преходящему блоку проведения нервного импульса по пораженному волокну. Разрушение миелина и последующая дегенерация аксона являются причинами стойкого блока проведения нервного импульса. Старая, неактивная бляшка PC, сероватого цвета и плотная на ощупь, характеризуется прежде всего реактивной пролиферацией астроцитов (астроглиоз) и уменьшением содержания олигодендроцитов. В некоторых случаях по краям старой бляшки могут наблюдаться новые зоны отека и периваскулярной инфильтрации, что указывает на возможность роста старых очагов.
Клинические проявления. В типичных случаях первые клинические симптомы PC появляются у лиц молодого возраста (от 18 до 45 лет), хотя в последнее время все чаще описывают дебют PC как у детей, так и у лиц старше 50 лет Первыми симптомами заболевания часто бывают ретро-бульбарные невриты (рис. 12.2), снижение остроты зрения, скотомы, ощущения нечеткости изображения, пелена перед глазами, преходящая слепот на один или два глаза (последнее при двустороннем процессе). Заболевание

| OS 90 |
 300 28& во 240
300 28& во 240
285 270 265
Рис. 12.2. Поля зрения при левостороннем ретробульбарном неврите. Централь
ная абсолютная скотома в поле зрения левого глаза. •
может начинаться с глазодвигательных расстройств (диплопия, косоглазие, межъядерная офтальмоплегия, вертикальный нистагм), неврита лицевого нерва, головокружения, пирамидных симптомов (центральный моно-, геми- или парапарез с высокими сухожильными и периостальными рефлексами, клонусами стоп, патологическими пирамидными рефлексами, исчезновением брюшных кожных рефлексов), мозжечковых нарушений (пошатывание при ходьбе, статическая и динамическая атаксия, интенционное дрожание, горизонтальный нистагм), расстройств поверхностной (онемение, диз- и парестезии) или глубокой чувствительности (сенситивная атаксия, сенситивный парез, гипотония). Наиболее ранними симптомами поражения проводя-ших путей могут быть быстрая истощаемость и исчезновение брюшных рефлексов, снижение вибрационной чувствительности и дизестезии, асимметрия сухожильных рефлексов. Значительно реже первыми признаками болезни могут быть невротические расстройства, синдром хронической усталости, нарушения функций тазовых органов (задержка мочеиспускания, императивные позывы), а также вегетативные нарушения.
Аналитические ретроспективные исследования показали, что дебют PC с ретробульбарного неврита и чувствительных расстройств и длительная первая ремиссия являются признаками более благоприятного течения заболевания, тогда как появление признаков поражения пирамидного тракта или путей мозжечка и короткая первая ремиссия (или первично прогредиентное течение, т.е. отсутствие ремиссий в целом) являются прогностически неблагоприятными. Как отражение вегетативно-эндокринных расстройств у жен-шин отмечается нарушение менструального цикла, у мужчин — импотенция. Прогрессирование PC приводит к поражению других отделов ЦНС и возникновению новых симптомов. Уже в начальных стадиях характерна повышенная утомляемость (синдром «хронической усталости»). В более поздних стадиях психопатологические изменения могут проявляться в виде эмоциональной неустойчивости, эйфории или депрессии, раздражительности, вялости, апатии, снижения интеллекта различной степени вплоть до леменции. Эпилептические припадки при PC встречаются редко, хотя у некоторых больных могут быть пароксизмальные изменения тонуса, неврал- !ские боли и другие пароксизмальные нарушения чувствительности. z ярким проявлением сенсорных пароксизмов при PC являются по типу синдрома Лермитта. Синдром Лермитта выражается в
болезненных неприятных ощущениях покалывания, напряжения, «прохождения тока» по спине от головы до ног, чаще при разгибании шеи. Предполагаемая причина — очаг демиелинизации в спинном мозге на шейном уровне с выраженным отеком. При этом механическая деформация, например, при разгибании шеи или активация поврежденных пирамидных волокон приводит к раздражению чувствительных волокон, проходящих через этот отдел, и возникновению своеобразных ощущений.
Имеется ряд характерных для PC симптомокомплексов, отражающих особенности клинического проявления демиелинизируюшего поражения. Среди них наиболее распространены синдромы «клинического расщепления», «непостоянства клинических симптомов» и «горячей ванны».
Синдром «клинического расщепления», или «диссоциации», был описан Д.А. Марковым и А.Л. Леонович. Авторы понимали этот синдром как разнообразные проявления несоответствия между симптомами поражения различных проводящих путей при PC. Этот синдром отражает сочетание у одного больного симптомов поражения разных проводящих путей или разных уровней поражения. Например, высокие сухожильные рефлексы, патологические стопные знаки наряду с выраженной гипотонией у больных PC наблюдаются при одновременном поражении пирамидного пути и проводников мозжечка, реже — при нарушении глубокой чувствительности. Одним из наиболее известных и хорошо изученных синдромов при PC является синдром «горячей ванны». Известно, что при повышении температуры окружающей среды состояние больных PC ухудшается. Этот синдром неспецифичен и отражает повышенную восприимчивость нервного волокна, лишенного миелиновой оболочки («изоляции»), к внешним воздействиям. Все эти изменения, как правило, носят преходящий, нестойкий характер, что является более специфичным для PC признаком, чем само ухудшение состояния. Для PC характерен клинический феномен колебания выраженности симптомов PC не только на протяжении нескольких месяцев или лет, но и в течение одних суток, что связано с большой чувствительностью демиелинизированного волокна к изменениям гомеостаза.
В целом клинические проявления PC могут быть разделены на 7 основных групп:
1) поражение пирамидной системы с теми-, пара- и тетрапарезами с
соответствующим повышением сухожильных рефлексов и патологи
ческими пирамидными симптомами; пг1„я„„
2) поражение мозжечка и его путей с развитием статической и динами-
ческой атаксии мышечной гипотонии;
3) Гарушения чувствительности, вначале глубокой с развитие,, сенси-
й и сенситивных парезов, а затем болевой и темпера-
| тивной атаксии |
ьного нерва (в том числе ретробульбарные невриты) со снижением остроты зрения и поямение^м скотому
зывов задержек мочеиспускания, в 7) нейропсихологические изменения, -.
депрессия, характерен синдром хронической усталости

 В большинстве случаев у больных имеются симптомы поражения и головного, и спинного мозга (цереброспинальная форма). В некоторых случаях б клинической картине преобладают симптомы поражения спинного мозга {спишиъная форма) или мозжечка (мозжечковая или гиперкинетическая форма). В последнем случае интенционное дрожание может быть настолько выраженным, что достигает степени гиперкинеза и делает невозможным любое целенаправленное движение. Возникают дисметрия, адиадохокинез, скандированная речь, выраженная атаксия.
В большинстве случаев у больных имеются симптомы поражения и головного, и спинного мозга (цереброспинальная форма). В некоторых случаях б клинической картине преобладают симптомы поражения спинного мозга {спишиъная форма) или мозжечка (мозжечковая или гиперкинетическая форма). В последнем случае интенционное дрожание может быть настолько выраженным, что достигает степени гиперкинеза и делает невозможным любое целенаправленное движение. Возникают дисметрия, адиадохокинез, скандированная речь, выраженная атаксия.
Течение. У 85—90 % больных заболевание имеет волнообразное течение с периодами обострений и ремиссий, которое после 7—10 лет болезни практически у всех больных сменяется вторичным прогрессировани-ем, когда наблюдается постепенное ухудшение состояния больных. В 10— % случаев PC с самого начала имеет первично прогрессирующее (про-гредиентное) течение. Тяжесть поражения нервной системы и темпы развития необратимых симптомов значительно варьируют у разных больных. Возможны как случаи «мягкого», «благоприятного» течения заболевания с периодами ремиссий или стабилизации на десятки лет, так и быстротекущие варианты (стволовая форма PC, или болезнь Марбурга). Истинное обострение PC следует дифференцировать от псевдообострений, когда ухудшение в состоянии больного связано не с активацией иммунопатологического процесса, а с неспецифическими изменениями гомеостаза. Они характеризуются временным углублением уже имеющихся у больного симптомов, а не появлением новых. Возможны субклинические обострения, когда новые очаги образуются в клинически немых зонах (перивентрикулярное белое вещество) и выявляются только при магнитно-резонансной томографии,
Различные изменения гомеостаза могут являться триггерами, провоцирующими обострение заболевания. Часто в этой роли выступают инфекции, психогенные стрессы, реже — травмы, переохлаждения и физическое перенапряжение, операции (особенно под наркозом), воздействие токсинов и радиации. Многолетние динамические наблюдения за больными женщинами с PC в разных странах Европы показали, что беременность и роды не влияют на кратковременный и долгосрочный прогноз при PC, а у многих больных индуцируют развитие стойкой длительной ремиссии. Искусственное прерывание беременности, особенно в поздние сроки, довольно часто является причиной тяжелых обострений PC.
Диагностика и дифференциальный диагноз. Клинический полиморфизм PC, обусловленный индивидуальным набором внешних и генетических факторов патогенеза, обусловливает значительные трудности ранней диагностики. С 1983 г. для постановки диагноза PC используются диагностические критерии С. Poser (табл. 12.1). Согласно этим критериям, заболевание должно проявиться в возрасте до 59 лет по меньшей мере двумя очагами поражения белого вещества ЦНС, возникновение которых должно быть разделено по времени не менее чем в один месяц.
Критерий разделения в локализации и во времени образования очагов («диссеминация в месте и времени») является основным при установлении клинически достоверного диагноза PC. Важно, что до установления диагноза PC должны быть исключены все другие причины такого многоочагового поражения ЦНС. Во многих случаях клинически не удается полностью выявить эти критерии: имеются симптомы, связанные только с одним очагом, и ремиттирующее течение заболевания или клинические признаки пораже-384
Таблица 12 1. Диагностические критерии рассеянного склероза Позера [Poser С. et а!„ 1983]
Категории
| Очаги, выявленные клинически |
| Количество обострений |
| Очаги, выявленные параклиниче скими методами |
Олигоююнальные IgG в
Цереброспинальной жидкости
Достоверный PC
— вариант А
— вариант В
| или и |
Лабораторно подтвержденный достоверный PC
— вариант, А
— вариант В
— вариант С
Вероятный PC
— вариант А
— вариант В
— вариант С
Лабораторно подтвержденный вероятный PC
ния двух одновременно возникших очагов в белом веществе и т.д. Для учета таких случаев введено понятие вероятного PC, когда диагноз может быть подтвержден или опровергнут после дополнительного обследования.
В диагностике PC, когда имеются клинические проявления только одного очага с характерным волнообразным течением процесса, важна верификация наличия нескольких очагов. Субклиническое поражение проводников можно выявить дополнительными методами. Первая группа методов — нейрофизиологические методы вызванных потенциалов, позволяющих при изменении латентности и амплитуды пиков кривых диагностировать повреждение соответствующей проводниковой системы (зрительные, соматосенсорные и коротколатентные стволовые вызванные потенциалы). Нейрофизиологические методы позволяют выявить субклинические очаги и подтвердить диагноз в 50—60 % случаев.
В 90 % случаев многоочаговое поражение подтверждается при магнитно-резонансной томографии головного мозга (рис. 12.3), когда регистрируется очаговое повышение интенсивности сигнала на Т2-взвешенных изображениях. Иногда при тяжелых длительных процессах очаги могут сливаться в зоны гиперинтенсивности, выявляется вторичная атрофия вещества головного мозга.
Высокоинформативно МРТ-исследование с использованием магне-виста и других контрастных веществ, как правило, на основе гадалиниума (Gd-DTPA). Парамагнитный контраст усиливает сигнал от зоны воспаления и отека (на Ti-взвешенных изображениях). Этот метод позволяет выявлять свежие очаги с повышением проницаемости ГЭБ, т.е. делает возможным мониторинг активности патологического процесса. Сравнения с данными патоморфологических исследований позволили сделать заключение, что усиление контрастом происходит исключительно в свежих очагах деми-
Дата публикования: 2014-11-18; Прочитано: 1703 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
