 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Выявление ферментативной активности микробов
|
|
В жизнедеятельности бактерий ферменты играют важную роль, так как являются обязательными участниками разнообразных биохимических реакций, лежащих в основе функций питания, дыхания, размножения.
Устойчивость ферментативных систем бактерий позволяет использовать их биохимические свойства в сочетании с морфологическими и культуральными признаками для определения видов микроорганизмов.
Для обнаружения ферментов используют только чистые культуры микроорганизмов, которые засевают на специальные дифференциально-диагностические среды. Преимущественное значение при исследовании биохимической активности бактерий имеют сахаролитические, протеолитические и окислительно-восстановительные ферменты.
Сахаролитические ферменты микробов. Сахаролитическая активность микроорганизмов определяется по ферментативному расщеплению многоатомных спиртов и углеводов при посеве их на дифференциально-диагностические среды. Различные виды микробов при оптимальных условиях по-разному относятся к одним и тем же сахарам, расщепляя одни и оставаясь нейтральными по отношению к другим. Этосвойство микробов используется в бактериологической практике для дифференциации различных видов и разновидностей бактерий.
На плотных, жидких и полужидких питательных средах, содержащих различные индикаторы (чаще всего индикатор Андреде), сахара под действием сахаролитических ферментов бактерий расщепляются на альдегиды и кислоты. Конечными продуктами их расщепления являются углекислый газ и водород. Накопление кислот снижает рН питательной среды, что приводит к изменению цвета индикатора и самой среды. Если бактерии не выделяют фермент к данному углеводу, то цвет индикатора и питательной среды не меняется. Поэтому набор питательных сред с индикаторами называют пестрым или цветным рядом.
Для обнаружения сахаролитических ферментов исследуемую культуру бактерий чаще всего засевают в цветные среды («пестрый ряд») Гисса (рец. 15) с углеводами и индикатором Андреде (рец. 16) или индикатором ВР (смесь водного голубого с розоловой кислотой). «Пестрый ряд» Гисса содержит обычно пять пробирок; с глюкозой, лактозой, маннитом, мальтозой и сахарозой. В некоторых случаях для более углубленного изучения биохимических свойств микроорганизмов «пестрый ряд» Гисса дополняют дульцитом, сорбитом, ксилозой, арабинозой. Сахара, применяемые для обнаружения сахаролитических ферментов, должны быть химически чистыми.
Среды Гисса бывают жидкие и полужидкие (с добавлением 0,5% агар-агара). В пробирки с жидкими питательными средами опускают бродильную трубочку (поплавок), которая представляет собою стеклянную трубочку, запаянную с одного конца. При стерилизации поплавок полностью заполняется питательной средой. При образовании в среде газообразных продуктов они вытесняют жидкость из поплавка с образованием воздушного колокола. В полужидких средах газообразование определяют по наличию пузырьков в толще среды.
Протеолитические ферменты микробов. Некоторые микроорганизмы продуцируют и выделяют во внешнюю среду протеолитические ферменты, катализирующие расщепление белков. В результате расщепления молекулы белка образуются высокомолекулярные промежуточные продукты распада - пептоны, аминокислоты и полипептиды.
Для выявления протеолитических ферментов исследуемую культуру микроорганизмов засевают в питательную среду, содержащую тот или иной белок. Чаще всего для этой цели применяют желатину, реже - свернутую лошадиную сыворотку, коагулированный яичный белок, молоко или кусочки вареного мяса.
Для определения протеолитической активности микроорганизмов на желатине готовят мясо-пептонную желатину (рец. 17) и разливают в пробирки столбиком по 5-6 мл. После застывания питательной среды производят посев уколом, погружая петлю в глубь питательной среды до дна пробирки.
Микробы, способные расти при низкой температуре, инкубируют при 20°С-22°С. Остальные посевы инкубируют при 37°С. При температуре 37°С желатина плавится, поэтому после инкубации вынутые пробирки помещают в холодильник или холодную воду для застывания среды. После застывания среды приступают к просмотру результатов роста микроорганизмов. При выделении протеолитического фермента желатиназы происходит расщепление белков и наблюдается разжижение питательной среды, с рисунком, характерным для определенных видов микроорганизмов (рис. 37). Например, сибиреязвенная палочка разжижает желатину желатину в виде воронки, стафилококки - в виде чулка, синегнойная палочка - послойно и т.д.
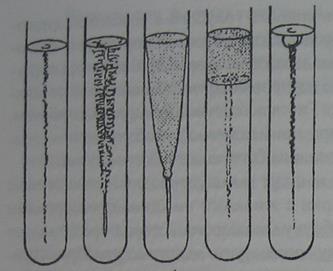
Рис. 37. Различные формы разжижения желатины микроорганизмами
Определение протеолитической активности микробов на молочном агаре Эйкмана. Готовят молочный агар Эйкмана, для чего к 10 мл стерильного расплавленного питательного агара добавляют 3 мл обезжиренного молока и смешивают. Молочный агар Эйкмана (рец. 18) разливают в чашки Петри и после остывания засевают исследуемым микроорганизмом петлей штрихами или шпателем, чтобы получить изолированные колонии. Через 24-48 часов инкубации в термостате культуры, продуцирующие протеолитические ферменты, разлагают молочный белок - казеин, в результате чего вокруг колоний образуются четкие прозрачные зоны на фоне мутной питательной среды.
Дата публикования: 2015-11-01; Прочитано: 4531 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
