 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Кислотно-основные свойства. Основные свойства. Благодаря неподеленной электронной паре кислородного атома альдегиды и кетоны обладают очень слабыми основными свойствами (рkвн = -6 -
|
|
Основные свойства. Благодаря неподеленной электронной паре кислородного атома альдегиды и кетоны обладают очень слабыми основными свойствами (рKвн = -6 - -8). При взаимодействии с кислотой (НХ) карбонильное соединение вначале образует с ней ассоциат за счет водородной связи, а потом уже протонированную форму:

Концентрация протонированной формы карбонильных соединений в 60-80 % H2S04 достигает = 1 %. Поэтому в большинстве реакций, где катализатором является протон, имеет место только образование водородной связи с карбонильным атомом кислорода, но уже и это значительно увеличивает реакционную способность электрофильного центра (1) карбонильной группы.
Кислотные свойства. Альдегиды и кетоны, имеющие водородный атом при а-углеродном атоме, являются очень слабыми СН-кислотами (рКа = 18 - 20), заметно более слабыми, чем спирты (pKa = 14 - 16). В водных растворах с рН = 12 - 13 содержание их аниона составляет только 10-2 - 10-5 % от неионизованной формы. Своеобразие строения аниона альдегидов и кетонов заключается в делокализации избыточной электронной плотности между a-углеродным атомом и кислородным атомом карбонильной группы вследствие их сопряжения (разд. 2.1.3):

Делокализация заряда в анионе карбонильного соединения приводит к возникновению в нем двух нуклеофильных (основных) центров: один на a-углеродном атоме, а другой - на кислородном. Анионы с делокализованным в сопряженной системе зарядом, имеющие два разных нуклеофильных центра, называются амбидентными. Протонирование амбидентного аниона карбонильного соединения приводит при С-протонировании к кето-таутомеру (КН), а при О-протонировании - к енол-таутомеру (ЕН), между которыми устанавливается динамическое равновесие, называемое кето-енольной таутомерией.
Кето-енольная таутомерия. Схема возникновения кето- и енол-таутомеров из их общего амбидентного аниона карбонильного соединения следующая:

Кето-енольная таутомерия - равновесная динамическая изомерия (разд. 15.2) карбонильных соединений КН —> ЕН - заключается в переносе протона от  -углеродного атома на кислородный атом карбонильной группы. Изменение положения протона в молекуле сопровождается изменением положения двойной связи: в кето-таутомере она находится между атомами углерода и кислорода, а в енол-таутомере - между углеродными атомами. Поскольку между кето- и енол-таутомерами осуществляется равновесный перенос протона, то такое равновесие называется прототропной таутомерией кето-енольного типа. Соотношение таутоме-ров в равновесном состоянии характеризуется константой тауто-мерного равновесия
-углеродного атома на кислородный атом карбонильной группы. Изменение положения протона в молекуле сопровождается изменением положения двойной связи: в кето-таутомере она находится между атомами углерода и кислорода, а в енол-таутомере - между углеродными атомами. Поскольку между кето- и енол-таутомерами осуществляется равновесный перенос протона, то такое равновесие называется прототропной таутомерией кето-енольного типа. Соотношение таутоме-ров в равновесном состоянии характеризуется константой тауто-мерного равновесия  или ее показателем
или ее показателем 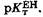

Константа таутомерного равновесия  связана с константами кислотности участвующих таутомеров
связана с константами кислотности участвующих таутомеров  и.
и.  следующим образом:
следующим образом:

Из представленных уравнений следует, что кето-енольная таутомерия, как и всякая прототропная таутомерия, совершаемая через общий амбидентный ион, смещена в сторону того тауто-мера, кислотные свойства которого слабее, а следовательно, его термодинамическая устойчивость выше. В монокарбонильных соединениях (альдегидах и кетонах) таутомерное равновесие практически полностью смещено в сторону кето-таутомера, так как его кислотность значительно меньше, чем енол-таутомера. Например, в ацетоне содержание енол-таутомера составляет всего 2,5 9* 10-4 %. При наличии у а-углеродного атома еще одного или двух электроноакцепторных групп резко увеличивается кислотность кето-таутомера и содержание енол-таутомера значительно возрастает. Так, в ацетилацетоне (1,3-дикарбонильное соединение) енольная форма преобладает:

Енол-таутомер ацетилацетона стабилизирован внутримолекулярной водородной связью и наличием в этом таутомере сопряжения между связями С=С и С=0, что уменьшает его кислотность.
Положение таутомерного равновесия зависит от природы не только карбонильного соединения, но и растворителя. Константы кислотности кето-таутомера (СН-кислота) и енол-таутомера (ОН-кислота) при замене растворителя меняются в разной степени вследствие различия сольватационных эффектов. Так, для ацетилацетона содержание енола и значения  и
и  изменяются в зависимости от растворителя следующим образом:
изменяются в зависимости от растворителя следующим образом:

Соединения, для которых наблюдается кето-енольная таутомерия, вступают в реакции, характерные для каждого тауто-мера и их общего аниона. При этом результат реакции зависит не столько от содержания этих форм, так как они находятся в равновесии, сколько от соотношения активности их реакционных центров. Поэтому результатом реакции может быть один или несколько продуктов в зависимости от природы субстрата и реагента, а также от условий проведения реакции, влияющих на состояние равновесия в таутомерной системе. Явлением кето-енольной таутомерии объясняется своеобразие химических свойств таких важных метаболитов, как углеводы, окси- и ке-токислоты. В заключение следует отметить, что кето-енольная таутомерия сопровождается внутримолекулярной окислительно-восстановительной дисмутацией за счет углеродных атомов с изменением их степеней окисления на единицу.
Дата публикования: 2014-10-16; Прочитано: 4070 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
