 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Химические свойства фенолов
|
|
Кислотно-основные свойства. Кислотность фенолов значительно выше (на 5-6 порядков), чем кислотность спиртов. Это определяется двумя факторами: большей полярностью связи О—Н из-за того, что неподеленная электронная пара атома кислорода вовлечена в сопряжение с бензольным кольцом (гидроксильная группа - сильный донор по +М-эффекту), и значительной стабилизацией образующегося фенолят-иона за счет делокализации отрицательного заряда с участием ароматической системы:

В отличие от алканолов фенолы при действии щелочей образуют соли - феноляты, растворимые в водных растворах щелочей (рН > 12). Однако фенолы плохо растворимы в водных растворах гидрокарбонатов щелочных металлов (рН = 8), так как в этих условиях феноляты подвергаются полному гидролизу.
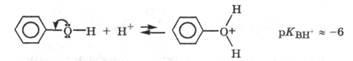
Основные свойства фенола выражены значительно слабее (на 4-5 порядков), чем у спиртов. Это связано с тем, что сопряжение неподеленной электронной пары кислородного атома с π-электро-нами бензольного кольца в образующемся катионе нарушено:
Ацилирование. Этерификация карбоновыми кислотами в присутствии H2SO4, характерная для спиртов, в случае фенола идет медленно из-за низкой нуклеофильности его кислородного центра. Поэтому для получения сложных эфиров фенола применяют более сильные электрофилы - хлорангидриды RC0C1 или ангидриды [(RCO)20] карбоновых кислот в безводных условиях:

 |
Алкилирование фенола. Нуклеофильность кислородного центра в фенолятах значительно выше, чем в феноле. Так, при обработке фенолята натрия галоидными алкилами образуются простые эфиры фенолов:
Все рассмотренные реакции фенолов происходят по связи О—Н. Реакции с разрывом связи С—О в фенолах, т. е. реакции замещения гидроксильной группы в феноле, в организме не происходят.
Окислительно-восстановительные свойства. Фенол легко окисляется на воздухе, из-за чего его белые кристаллы быстро розовеют. Состав образующихся продуктов точно не установлен.
Фенолы имеют характерную цветную реакцию с FeCl3 в водных растворах с появлением красно-фиолетового окрашивания, которое исчезает после прибавления сильной кислоты или спирта. Предполагают, что интенсивная окраска связана с образованием комплексного соединения, содержащего во внутренней сфере фенолят-анион:

В этом комплексе из всех лигандов фенолят-анион - самый активный нуклеофил и восстановитель. Он способен передать один электрон электрофилу и окислителю - катиону железа(3) - с образованием во внутренней сфере ион-радикальной системы, содержащей феноксильный радикал (C6H5O*), что приводит к появлению интенсивной окраски:

Подобное образование радикалов во внутренней сфере комплексного соединения за счет внутрисферного окислительно-восстановительного процесса может происходить и в субстрат-ферментных комплексах организма. При этом радикальная частица может или оставаться связанной во внутренней сфере, или становиться свободной при выходе из этой сферы.
Рассмотренная реакция с FeCl3 свидетельствует о легкости окисления фенола, особенно его аниона. Еще легче окисляются многоатомные фенолы. Так, гидрохинон (особенно его дианион) легко окисляется за счет углеродных атомов в 1,4-бензохинон:
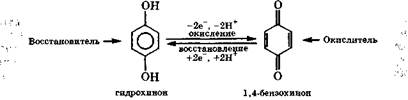
Гидрохинон используется в фотографии, поскольку он. восстанавливает AgBr в фотографической эмульсии на засвеченных участках быстрее, чем на незасвеченных.
Соединения, содержащие 1,4-хиноидную группировку, называют хинонами. Хиноны - типичные окислители, образующие с соответствующими гидрохинонами равновесную сопряженную окислительно-восстановительную пару (разд. 9.1). Такая пара в коферменте Q участвует в процессе окисления субстрата за счет дегидрирования (разд. 9.3.3) и переноса электронов по электронотранспортной цепи от окисляемого субстрата к кислороду (разд. 9.3.4). Витамины группы К, содержащие нафтохиноновую группировку, обеспечивают свертывание крови на воздухе.
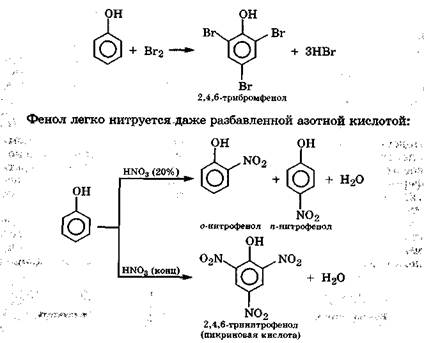
Электрофильное замещение по бензольному кольцу. Благодаря электронодонорному эффекту гидроксильной группы фенол значительно легче вступает в реакции электрофильного замещения, чем бензол. Гидроксильная группа ориентирует атаку электрофила в о- и n-положения. Например, фенол обесцвечивает бромную воду при комнатной температуре с образованием 2,4,6-трибромфенола:
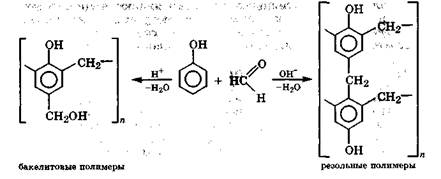 |
Активность фенола в реакциях электрофильного замещения настолько велика, что он реагирует даже с альдегидами. Эта реакция поликонденсации лежит в основе получения различных фенолоформальдегидных смол, широко используемых в промышленности. При проведении поликонденсации в кислой среде образуются бакелитовые полимеры, а в щелочной среде, где реакция идет глубже из-за высокой активности фенолят-аниона, - резольные полимеры:
Важнейшие представители спиртов и их практическое значение. Алканолы - физиологически активные вещества, обладающие наркотическим действием. Это действие возрастает с разветвлением и удлинением углеродной цепи, проходя через максимум при C6-C8, а также при переходе от первичных спиртов к вторичным. Продукты превращения спиртов в организме могут служить причиной их токсического действия.
Метанол СН3ОН - сильный яд, так как в пищеварительном тракте окисляется в формальдегид и муравьиную кислоту. Уже в небольших дозах (10 мл) может вызвать слепоту.
Этанол С2Н5ОН, обычно называемый просто спирт. Употребление этанола (алкогольных напитков) действует вначале возбуждающе, а затем угнетающе на центральную нервную систему, притупляет чувствительность, ослабляет функцию мозга и мышечной системы, ухудшает реакцию. Его длительное и неумеренное употребление приводит к алкоголизму. Механизм действия этанола на организм чрезвычайно сложен и окончательно еще не выяснен. Однако важной стадией его превращения в организме является образование ацетальдегида, который легко реагирует со многими важными метаболитами.
Этиленгликоль НОСН2СН2ОН - сильный яд, так как продуктами его превращения в организме являются щавелевая кислота и другие не менее ядовитые соединения. Обладает спиртовым запахом, в связи с чем может быть принят за этанол и явиться причиной тяжелых интоксикаций. Используется в технике как антиобледенитель и для приготовления антифризов -жидкостей с низкой температурой замерзания, применяемых для охлаждения двигателей зимой.
Глицерин НОСН2СН(ОН)СН2ОН - нетоксичная, вязкая, бесцветная жидкость сладкого вкуса. Он входит в состав большинства омыляемых липидов: животных и растительных жиров, а также фосфолипидов. Применяется для производства тринитрата глицерина, в качестве мягчителя в текстильной и кожевенной промышленности и как составная часть косметических препаратов для смягчения кожи.
Биологически активными спиртами являются многие метаболиты, относящиеся к разным классам органических соединений: ментол — класс терпенов; ксилит, сорбит, мезоинозит -многоатомные спирты; холестерин, эстрадиол - стероиды.
Дата публикования: 2014-10-16; Прочитано: 7046 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
