 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Тиолы и сульфиды
|
|
Тиолы R—SH и сульфиды R—S—R являются серными аналогами спиртов и простых эфиров. Их можно рассматривать и как производные сероводорода, в которых водородные атомы заменены органическими радикалами.
Тиольная группа в тиолах содержит разные реакционные центры, и поэтому она может выступать и электрофилом, и нуклеофилом, а также склонна к образованию радикалов:

Кислотно-основные свойства. Будучи производными сероводорода, тиолы проявляют слабые кислотные свойства, но кислотность группы SH значительно больше (на 5-6 порядков), чем кислотность гидроксильной группы в спиртах:

Высокая кислотность тиолов и сероводорода по сравнению со спиртами и водой связана с большим радиусом атома серы, что благоприятствует большей поляризуемости этого реакционного центра. Это способствует увеличению стабильности серосодержащих анионов и силы серосодержащих кислот. Поэтому тиолы, в отличие от спиртов, реагируют со щелочами, а также оксидами, гидроксидами и солями тяжелых металлов с образованием тиолятов (тривиальное название меркаптиды):
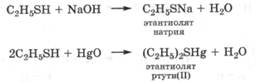
Тиоляты тяжелых металлов не растворяются в воде. В тиолятах катионы d-металлов связываются очень прочно, так как и катион, и анион легкополяризуемы и связь между ними практически становится ковалентной.
Прочное связывание тиолами катионов "металлов жизни" принципиально важно, так как это приводит к образованию устойчивых металлопротеинов, включая металлоферменты, являющиеся типичными комплексными соединениями (разд. 10.4). С другой стороны, эта способность природных тиолов является причиной высокой токсичности катионов металлов-токсикантов: свинца, кадмия, ртути, мышьяка. Поскольку катионы металлов-токсикантов являются более поляризуемыми ("мягкими"), чем катионы "металлов жизни", то они вытесняют последние из природных металл опротеинов, образуя при этом соединения более прочные и лишенные необходимых биологических свойств.
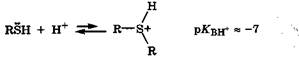
Тиолы за счет неподеленной электронной пары атома серы могут присоединять протон, проявляя основные свойства, но это происходит только в концентрированных сильных кислотах (c(H2S04) > > 70 %), что указывает на очень слабые основные свойства тиолов:
Нуклеофильно-электрофильные реакции. Легкополяризуемый атом серы в молекулах тиолов и сульфидов проявляет ярко выраженный нуклеофильный характер. Поэтому данные соединения, и особенно их тиолят-анионы, вступают в реакции с органическими производными как активные нуклеофилы.
Этерификация и переэтерификация. Тиолы легко ацилируются карбоновыми кислотами с образованием сложных тиоэфиров (реакция этерификации):

Сложные тиоэфиры из-за наличия легкополяризуемого нук-леофильного центра, содержащего атом серы, легко гидролизуются и взаимодействуют со спиртами, т. е. вступают в реакции нуклеофильного замещения:

Реакция сложных тиоэфиров со спиртами относится к реакциям пере этерификации.
Способность тиолов и сложных тиоэфиров легко вступать в реакции этерификации и переэтерификации используется в организме для переноса ацильных групп с помощью кофермента А, содержащего тиольную группу (KoA-SH):
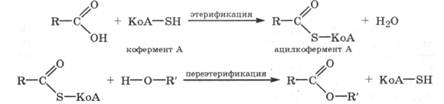
Таким образом, кофермент А играет важную роль в процессах обмена веществ: активируя карбоновые кислоты, превращает их в реакционноспособные сложные тиоэфиры (ацилкофермент А). Чаще всего кофермент А активирует уксусную кислоту, превращая ее в ацетилкофермент A (CH3C(0)SKoA), который в организме служит переносчиком ацетильной группы на нуклеофильные субстраты: алканолы, амины и другие (разд. 19.2.2).
Алкилирование. Тиолят-анионы, являясь активными нуклеофилами, легко вступают в реакцию алкилирования с алкилгалогенидами, образуя сульфиды:

Сульфиды, за счет неподеленной электронной пары атома серы, выступают нуклеофилами и реагируют с активными электрофилами, например CH3I, образуя сульфониевые соли:
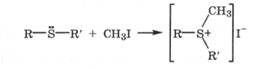
В сульфониевых солях реакционный центр на положительно заряженном атоме серы является электрофильным и вследствие высокой поляризуемости связи С—S легко алкилирует нуклеофилы, например амины:

В организме подобная реакция совершается с участием аминокислоты метионина, содержащей сульфидную группировку СН3—S—R, которая при взаимодействии с аденозином (А) образует сульфониевую соль - S-аденозилметионин  Эта сульфониевая соль в организме метилирует природные азотистые нуклеофилы: коламин, норадреналин, никотинамид. Например, метилирование коламина приводит к получению холина:
Эта сульфониевая соль в организме метилирует природные азотистые нуклеофилы: коламин, норадреналин, никотинамид. Например, метилирование коламина приводит к получению холина:

Сильным алкилирующим реагентом является боевое отравляющее вещество сернистый иприт S(CH2CH2C1)2, который активно алкилирует многие метаболиты организма по их электрофильным центрам. Для дегазации иприта используется или щелочной гидролиз, или окисление хлорной известью либо хлораминами до сульфоксида или сульфона:

Окислительно-восстановительные реакции. Тиолы и сульфиды содержат атом серы в наименьшей степени окисления -2, как и в сероводороде, проявляя поэтому сильные восстановительные свойства.
Тиол-дисульфидное равновесие. Окисление тиолов слабыми окислителями приводит к образованию дисульфидов (R—S-S-R), при этом степень окисления серы повышается с -2 до -1 и одновременно высвобождаются два протона, причем реакция обратима, так как абсолютная величина ее восстановительного потенциала не превышает 0,3 В:

Превращение тиолов в дисульфиды, вероятно, протекает через промежуточные тиокси-радикалы (RS*), которые вследствие высокой поляризуемости ("мягкости") реагируют преимущественно между собой с образованием дисульфидов:

тиол-дисульфидная система составляет сопряженную окислительно-восстановительную пару, в которой под действием слабых окислителей или слабых восстановителей происходят взаимные превращения. Этот процесс используется для поддержания окислительно-восстановительного гомеостаза в организме и в работе антиоксидантной буферной системы (разд. 9.3.9 и 12.2.6).
При излишнем накоплении в организме окислителей, например за счет свободнорадикального окисления, их действие прежде всего направляется на белки, содержащие аминокислоту цистеин (Cys—SH), которая, окисляясь, превращается в цистин (Cys—S-S-Cys):

В результате цистеиновые фрагменты белка сшиваются кова-лентными дисульфидными мостиками, что приводит к фиксации новой конформации (пространственной структуры) белка и к нарушению его биологических функций.
Тиолсодержащие компоненты антиоксидантной буферной системы, принимая на себя действие окислителя, защищают белки со свободными тиольными группами от окисления. С этой целью в организме используются тиол-дисульфидные сопряженные окислительно-восстановительные пары на основе трипептида глютатиона (G—SH) и дигидролипоевой кислоты (разд. 9.3.9 и 12.2.6):

Для увеличения буферной емкости антиоксидантной системы организма используются препараты, содержащие более одной тиольной группы: дитиоглицерин HSCH2CH(SH)CH20H (БАЛ), уни-тиол HSCH2CH(SH)CH2S03H, сукцимер (-CH(SH)C00H)2. Эти же препараты являются антидотами катионов металлов-токсикантов, а также отравляющего вещества люизит ClCH=CHAsCl2 (разд. 9.3.9, 10.5, 12.2.6).
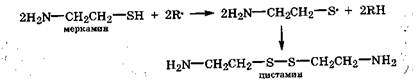 |
При радиоактивном облучении в организме резко увеличивается концентрация свободных радикалов - активных форм кислорода, образующихся из воды (разд. 9.3.9, 12.2.5). Это, естественно, вызывает нарушение окислительно-восстановительного гомеостаза клетки и организма в целом. Для предотвращения тяжелых последствий используют радиопротекторы (вещества, смягчающие последствия радиоактивного облучения), например меркамин (аминотиол), который, воспринимая действие жестких радикалов и окислителей, легко образует тиоксирадикалы, которые, взаимодействуя между собой, превращаются в циста-мин (аминодисульфид):
Таким образом, тиол-дисульфидное равновесие используется организмом для защиты от действия окислителей, восстановителей и радикальных частиц.
Окисление сильными окислителями. Тиолы и сульфиды при действии азотной кислоты, перманганата, пероксида водорода, хлорной извести превращаются в производные серы со степенью окисления +4 и +6. Так, сульфиды образуют сулъфоксиды или сульфоны:
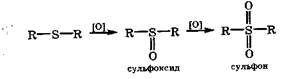
Среди сульфоксидов особого внимания заслуживает диметилсульфоксид (СН3)2SO, который применяется в медицине как растворитель для накожного введения некоторых лекарственных препаратов. Этот полярный растворитель (s = 43) уникален, так как хорошо растворяет одновременно и малополярные и сильнополярные вещества, и даже некоторые соединения с ионной связью. В результате молекулы диметилсульфоксида легко проникают через клеточные мембраны, а его низкая токсичность позволяет использовать этот растворитель в биологии и медицине.

Глава 18
Дата публикования: 2014-10-16; Прочитано: 9284 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
