 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Химические свойства спиртов
|
|
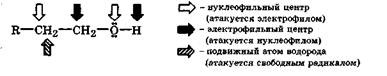
Химические свойства спиртов обусловлены в основном наличием в их молекулах полярных связей 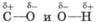 и соответственно довольно жесткого нуклеофильного центра на атоме кислорода и двух электрофильных центров: жесткого на водородном атоме гидроксильной группы и мягкого на углеродном атоме, связанном с гидроксильной группой:
и соответственно довольно жесткого нуклеофильного центра на атоме кислорода и двух электрофильных центров: жесткого на водородном атоме гидроксильной группы и мягкого на углеродном атоме, связанном с гидроксильной группой:
Кислотно-основные свойства. Одноатомные спирты проявляют настолько слабые кислотные свойства, что содержание протонов в их водных растворах практически не изменяется. Только в концентрированных спиртовых растворах щелочей (с(КОН) > 20 %) происходит незначительная ионизация спиртов с образованием алкоголят-аниона:
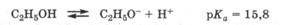
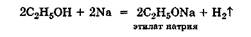 |
Однако при действии на спирты щелочных металлов происходит необратимое замещение катионов водорода спирта на катионы металла с образованием алкоголятов и свободного водорода:
Эта реакция идет значительно медленнее, чем реакция натрия с водой.
Кислотные свойства спиртов уменьшаются при наличии в молекуле вблизи гидроксильной группы электронодонорных заместителей, например алкильных групп. Так, третичные спирты проявляют наиболее слабые кислотные свойства (для (СН3)3СОН рКа = 19,2). Противоположное действие оказывают электроноакцепторные заместители, которые, уменьшая электронную плотность на атоме кислорода, увеличивают кислотность спиртов и фенолов, т. е. значение их рKа уменьшается:
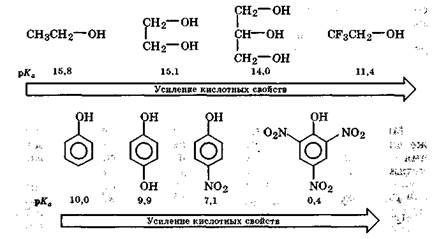 |
Резкое усиление кислотных свойств 2,4,6-тринитрофенола (пикриновой кислоты) обусловлено не только согласованным действием электроноакцепторных нитрогрупп, но и стабилизацией его аниона за счет эффективной делокализации отрицательного заряда.
Наряду с кислотными свойствами спирты за счет неподеленной электронной пары на кислородном атоме могут также проявлять очень слабые основные свойства, образуя алкилоксо-ниевый катион по донорно-акцепторному механизму:
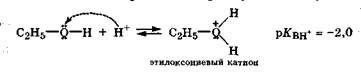
Образование алкилоксониевого катиона спиртов в заметных количествах возможно только в достаточно концентрированных растворах сильных кислот (c(H2S04) > 25 %).
Таким образом, спирты, хотя и проявляют амфотерность, но и кислотные, и основные их свойства чрезвычайно слабы. Однако во многих реакциях спирты на начальной стадии ведут себя как кислоты, или как основания, или как амфолиты. При этом происходит гетеролитический разрыв полярных связей или R—ОН, или RO-H.
Химические реакции, в которые вступают спирты, можно разделить на три группы:
- реакции, сопровождающиеся только замещением атома водорода гидроксильной группы, т. е. с разрывом связи RO—Н;
- реакции, сопровождающиеся замещением или отщеплением гидроксильной группы, т. е. с разрывом связи R—ОН;
- окислительно-восстановительные реакции, в которых одновременно могут принимать участие электроны RO—Н и R—ОН связей гидроксильной группы, а также связи С—Н и С—С соседних с ней групп.
Реакции, сопровождаемые разрывом связи RO — Н. В этих реакциях молекула спирта, отдавая катион водорода, выступает как кислота, хотя и очень слабая. Однако все спирты способны при взаимодействии со щелочным металлом замещать свой катион водорода на катион щелочного металла:

Многоатомные спирты, как более сильные кислоты, к тому же способные образовывать устойчивые комплексные соединения - хелаты, реагируют в щелочной среде с гидроксидами d- металлов:
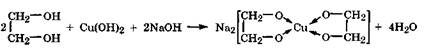
Реакция с Си(ОН)2 сопровождается появлением интенсивной синей окраски, поэтому она используется как качественная реакция на многоатомные спирты.
Этерификация. Спирты реагируют с кислородсодержащими кислотами с образованием соответствующего сложного эфира и воды, т. е. новых устойчивых соединений. Эта реакция называется этерификацией. Спирты вступают в реакцию этерификации с органическими кислотами в присутствии каталитических количеств сильных минеральных кислот, а также непосредственно с минеральными кислотами (HNO3, H2SO4, Н3РО4):
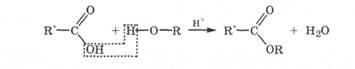
Первой стадией реакции этерификации является превращение карбоновой кислоты в активную электрофильную частицу. Это происходит в результате присоединения протона добавленной сильной кислоты к карбонильному атому кислорода карбоновой кислоты с образованием дигидроксикарбкатиона - активного электрофила:
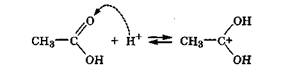
В дальнейшем происходит атака электрофилом нуклеофильного центра на атоме кислорода молекулы спирта с образованием сложного эфира и отщеплением молекулы воды и протона:
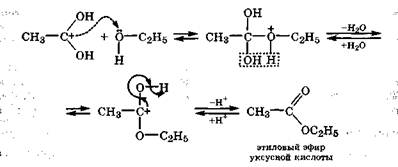 |
Реакция этерификации обратима, так как вода в присутствии кислот или щелочей разлагает сложные эфиры на исходные вещества. Такой гидролитический распад сложных эфиров называется гидролизом в случае кислой среды или омылением в случае щелочной среды.
Особенностью реакций этерификации, происходящих в организме, где содержание воды превышает 50 %, заключается в том, что они протекают в субстрат-ферментном комплексе. В этом комплексе вокруг реакционного центра, за счет определенной конформации белка фермента, располагаются в основном его неполярные фрагменты, что способствует удалению воды из зоны реакции в результате гидрофобных взаимодействий и благоприятствует этерификации субстрата.
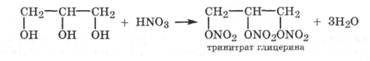
Этерификация спиртов под действием концентрированной азотной кислоты приводит к образованию алкилнитратов RONO2. Так, из глицерина образуется тринитрат глицерина - чувствительное и мощное взрывчатое вещество. В медицинской практике оно используется в небольших дозах как сосудорасширяющий препарат под неправильным названием "нитроглицерин" (общая формула нитросоединений R—N02, a R—ONO2 -общая формула нитратов):
При этерификации спиртов концентрированной серной кислотой образуются алкилсерные кислоты ROSO3H:

Эта реакция используется для получения эффективных поверхностно-активных веществ алкилсульфатов ROSO3Na - производных прямоцепочечных спиртов (R = С10-С18), используемых для приготовления синтетических моющих средств (разд. 26.6, 27.3.3).
Этерификация различных спиртов фосфорной кислотой играет важную биологическую роль, так как образующиеся алкил фосфорные кислоты R0P0(0H)2 и диалкилфосфорные кислоты. (R0)2P0(0H) - важные компоненты многих метаболических процессов и сами являются важными метаболитами: АТФ, нуклеиновые кислоты, фосфолипиды.
Поскольку при этерификации спиртов карбоновыми кислотами происходит формальное замещение водородного атома гидроксильной группы на ацильную группу, то этот процесс часто называется реакцией ацилирования, а в случае этерификации уксусной кислотой, когда вводится группа 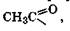 - реакцией ацетилирования. Эти термины широко используются при описании биохимических процессов наряду с общим термином "этерификация" (разд. 19.2.2).
- реакцией ацетилирования. Эти термины широко используются при описании биохимических процессов наряду с общим термином "этерификация" (разд. 19.2.2).
Реакции, сопровождаемые разрывом связи R—OH. Гидроксильная группа спирта может атаковаться жестким электрофилом реагента (Н+) по жесткому нуклеофильному центру - атому кислорода. При этом образуется промежуточный оксониевый комплекс, т. е. спирт выступает как основание. Оксониевый комплекс неустойчив и, отщепляя воду, превращается в алкильный карбкатион, который активно взаимодействует с нуклеофильной частицей реагента. В результате происходит реакция нуклеофильного замещения гидроксильной группы спирта. Например, под действием НВг или лучше HI (сильные кислоты) происходит замещение гидроксильной группы спирта на галогенид-анион:
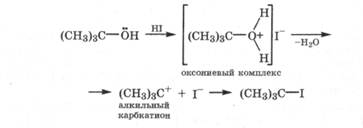
Эта реакция лучше всего протекает с третичными спиртами, так как они более сильные основания и их карбкатион наиболее устойчив. Если не удалять воду, то реакция спирта с галогено-водородом обратима, особенно в случае НСl. Поэтому реакцию ведут в присутствии водоотнимающего средства (H2SO4 (конц)) или используют галогенангидриды РСl5, РВr5, РОСl3, РС13, Р1з, SOCI2, которые даже при следовых количествах воды, связывая ее, являются источником безводных галогеноводородов.
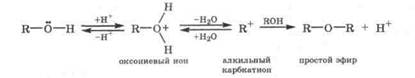 |
Межмолекулярная дегидратация спиртов. Безводные спирты при нагревании (Т < 140 °С) в присутствии небольших количеств H2SO4 (конц) подвергаются межмолекулярной дегидратации с образованием простых диалкиловых эфиров:
В этом случае молекулы спирта выступают как амфолит, так как одна молекула спирта, которая присоединила протон с образованием оксониевого иона, выступает как основание, а другая молекула спирта, реагируя с алкильным карбкатионом и отщепляя протон, выступает как кислота.
Межмолекулярная дегидратация первичных алканолов идет с хорошим выходом. В случае вторичных и особенно третичных алканолов лучше протекает их внутримолекулярная дегидратация с образованием алкенов. Подобная реакция происходит и с первичными спиртами, но при избытке кислоты и температуре более 180 °С. В отличие от межмолекулярной, внутримолекулярная дегидратация спиртов с образованием алкенов является окислительно-восстановительной реакцией.
Окислительно-восстановительные реакции спиртов. Сопоставим реакции дегидратации спиртов, протекающие межмолекулярно (А) и внутримолекулярно (Б), с позиции изменения степеней окисления углеродных атомов спирта:
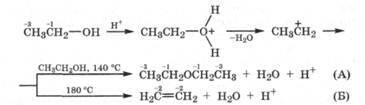
Как видно из этой схемы, внутримолекулярная дегидратация спирта сопровождается изменением степеней окисления углеродных атомов и является реакцией самоокисления-самовосстановления (дисмутации) за счет атомов углерода. Проанализируем окислительно-восстановительные превращения первичных, вторичных и третичных карбкатионов:
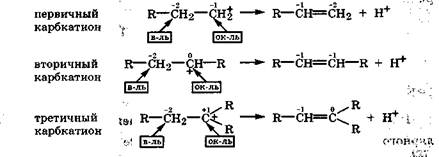
Из приведенных схем видно, что самоокисление-самовосстановление наиболее вероятно в карбкатионе с третичным углеродным атомом, так как у него наибольшая степень окисления +1. Это полностью согласуется с известным фактом, что внутримолекулярная дегидратация легче всего происходит у третичных спиртов. Использование степеней окисления углеродных атомов в молекулах спиртов позволяет объяснить с новой позиции правило Зайцева:
При внутримолекулярной дегидратации спиртов преимущественное отщепление протона происходит от соседнего наименее гидрогенизированного углеродного атома
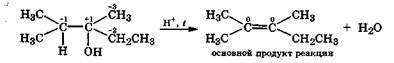
Среди ближайших к реакционному центру углеродных атомов наименее гидрогенизированный всегда имеет наибольшую степень окисления и соответственно максимальную протонодонорную способность, что и отражает правило Зайцева.
В организме реакция дегидратации спиртов происходит под действием ферментов в субстрат-ферментном комплексе, где отщеплению воды способствуют гидрофобные взаимодействия с неполярными фрагментами белков в области реакционного центра. При катализе обратной реакции - гидратации белок фермента так изменяет свою конформацию, что в области реакционного центра повышается содержание полярных фрагментов, что способствует обогащению центра молекулами воды и протеканию реакции гидратации. Реакции гидратации и дегидратации постоянно имеют место при распаде и синтезе углеводов и высших жирных кислот и играют большую роль в жизнедеятельности организмов.
Дегидрирование спиртов. При пропускании паров спирта при 200-300°С над мелко раздробленным металлом: Си, Ag, Pt, Pd - происходит выделение свободного водорода - дегидрирование, первичные спирты окисляются в альдегиды, а вторичные - в кетоны:
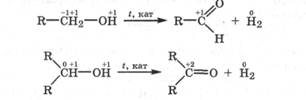
Реакция дегидрирования является реакцией внутримолекулярного окисления углеродного атома 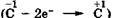 и вое становления водородных атомов
и вое становления водородных атомов 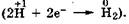 Причем передача электронов, по-видимому, происходит через металл-катализатор, выполняющий роль посредника в этом процессе. Третичные спирты дегидрированию не подвергаются ввиду отсутствия в их молекулах водородного атома при атоме углерода, связанном с гидроксильной группой.
Причем передача электронов, по-видимому, происходит через металл-катализатор, выполняющий роль посредника в этом процессе. Третичные спирты дегидрированию не подвергаются ввиду отсутствия в их молекулах водородного атома при атоме углерода, связанном с гидроксильной группой.
В организме дегидрирование спиртов происходит под действием дегидрогеназ с соответствующими коферментами, но свободный водород при этом не выделяется (разд. 9.3.5):
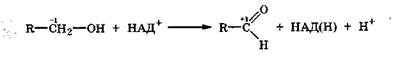
Это связано с тем, что два электрона от а-углеродного атома спирта переходят к углеродным атомам НАД+, а не атомам водорода молекулы спирта. Атом водорода —О—Н-группы спирта уходит в виде Н+ во внутриклеточную жидкость, а атом водорода при а-углеродном атоме непосредственно переходит к атому углерода в образующейся молекуле НАД(Н) (разд. 9.3.3).
Окисление спиртов. Частичное окисление спиртов КМn04 или К2Сг207 в кислой среде приводит в случае первичных спиртов к альдегидам, а вторичных спиртов - к кетонам:
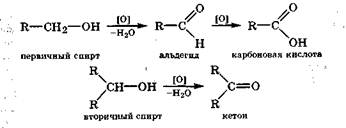
Поскольку альдегиды в отличие от кетонов легко окисляются в соответствующие карбоновые кислоты, то частичное окисление первичного спирта часто происходит до карбоновой кислоты.
Частичное окисление третичного спирта требует более жестких условий и происходит с разрывом межуглеродных связей, ближайших к гидроксигруппе, с образованием карбоновой кислоты и кетона:
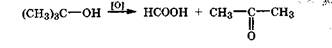
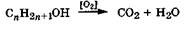 |
При горении происходит полное окисление спиртов с образованием оксида углерода(4) и воды:
Дата публикования: 2014-10-16; Прочитано: 11111 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
