 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Строение и реакционная способность алканов
|
|
Алканы играют исключительно важную роль в живой природе и деятельности человека, поскольку углеводородные цепи, с одной стороны, составляют основу гидрофобных свойств живой материи, а с другой - являются основным источником энергии. Газ на кухне, бензин в машинах, авиационное и дизельное топливо, мазут — все эти виды горючего представляют собой смеси различных алканов. Природными источниками алканов являются природный газ и нефть, которые образовались в результате медленного разложения остатков растений и животных, что свидетельствует о химической устойчивости алканов.
Самым простым алканом является метан СH4. Другие алканы можно рассматривать как производные метана, отличающиеся от него наличием одной или более метиленовых групп —СН2— и составляющих гомологический ряд предельных углеводородов общей формулы СnН2n+2, где n - число атомов углерода. Наименования четырех первых алканов (тривиальные) сложились исторически, названия последующих гомологов производят от греческих числительных, используя окончание -ан. Алканы могут иметь углеродную цепь неразветвленную (прямоцепочечную) и разветвленную. Это наблюдается начиная с бутана, для которого возможна структурная изомерия углеродной цепи:
 |
Число структурных изомеров алканов быстро растет с увеличением числа углеродных атомов. Так, пентан C5H12 имеет 3 изомера, октан С8Н18 - 18, декан С10Н22 - 75, эйкозан С20Н42 _ 366 319.
В углеродной цепи различают первичные (RCH3), вторичные (RCH2R), третичные (R3CH) и четвертичные (R4C) углеродные атомы в зависимости от числа других углеродных атомов, с которыми связан данный атом:

При отнятии от молекулы алкана одного водородного атома получается остаток, называемый алкильной группой или алкильным заместителем. Названия алкильных групп образуют из названия соответствующего алкана, заменяя суффикс -ан на -ил:
 |
Термин «алкильный радикал» не следует путать с термином «свободный алкильный радикал», относящимся к активной химической частице с неспаренным электроном.
Физико-химические свойства алканов. Атомы углерода в алканах находятся в sр3-гибридном состоянии (разд. 2.1.3) и имеют тетраэдрическую геометрию с валентными углами 109,5°. Фрагменты молекул алканов могут свободно вращаться относительно друг друга вокруг связи С—С, поэтому для них характерны различные конформации. Молекулы алканов, особенно длинноцепочечные, стремятся пребывать в наиболее энергетически выгодной зигзагообразной конформации (разд. 15.2).
Молекулы алканов имеют небольшой дипольный момент, так как содержат только 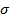 -связи С—С и С—Н, неполярные и слабополярные соответственно. Поэтому между соседними молекулами алканов возникает весьма слабое притяжение (разд. 3.1). Силы притяжения настолько слабы, что низшие алканы, от метана до бутана включительно, при нормальных условиях - газы. Линейные молекулы высших алканов располагаются параллельно друг другу так, чтобы межмолекулярные взаимодействия имели место по всей длине цепи. В результате алканы С5— С17 -жидкости, а начиная с С18 - твердые вещества. Межмолекулярные взаимодействия у алканов с разветвленной углеродной цепью заметно слабее, поэтому температуры кипения разветвленных алканов ниже, чем у их неразветвленных изомеров.
-связи С—С и С—Н, неполярные и слабополярные соответственно. Поэтому между соседними молекулами алканов возникает весьма слабое притяжение (разд. 3.1). Силы притяжения настолько слабы, что низшие алканы, от метана до бутана включительно, при нормальных условиях - газы. Линейные молекулы высших алканов располагаются параллельно друг другу так, чтобы межмолекулярные взаимодействия имели место по всей длине цепи. В результате алканы С5— С17 -жидкости, а начиная с С18 - твердые вещества. Межмолекулярные взаимодействия у алканов с разветвленной углеродной цепью заметно слабее, поэтому температуры кипения разветвленных алканов ниже, чем у их неразветвленных изомеров.
Жидкие алканы легче воды и не смешиваются с ней. Низкая растворимость алканов в воде объясняется тем, что молекулы углеводородов сильнее взаимодействуют друг с другом, чем с молекулами воды. Кроме того, молекулы алканов практически неполярны и неполяризуемы, а молекулы воды - полярны и поляризуемы, т. е. это вещества с прямо противоположными свойствами. Поэтому между молекулами этих веществ силы притяжения ничтожны и преобладают силы отталкивания, т. е. гидрофобные межмолекулярные взаимодействия (разд. 3.1), которые приводят к гидрофобным свойствам углеводородов и их производных и к расслаиванию алканов и воды. В то же время молекулы алканов до С8, которые имеют небольшие размеры, способны заполнять свободные полости водных ассоциатов, что обеспечивает их незначительную растворимость в воде. При этом, находясь в полости, молекула алкана структурирует вокруг себя каркас из молекул воды (разд. 6.1). С этой особенностью поведения низших алканов в воде связано их анестезирующее действие при попадании в организм (разд. 11.4).
Химические свойства алканов. Начальное название алканов парафины - от parum - мало + affinis - сходство, родство (лат.) - говорит об инертности этих соединений в химических реакциях. Но фактически они не так уж инертны, особенно при наличии свободных радикалов, которые способствуют гомолитическому разрыву связи С-Н в алканах. Ниже приведена схема реакций, характерных для алканов, протекающих по сво-боднорадикальному механизму:

Как видно из схемы, все эти реакции сопровождаются изменением степени окисления атомов углерода, т. е. являются окислительно-восстановительными реакциями. При этом реакции замещения атомов водорода в алканах являются межмолекулярными окислительно-восстановительными реакциями, а реакции изомеризации их углеродного скелета и термического превращения - реакциями дисмутации, т. е. самоокисления-самовосстановления за счет атомов углерода (а в ряде случаев и атомов водорода) алкана.
Реакции замещения. Для алканов реакции замещения протекают при взаимодействии с химически активными окислителями, легко образующими радикалы, например с галогенами, азотной кислотой, кислородом; при этом сами алканы выступают восстановителями.
Окисление алканов галогенами. Под действием света в молекулах галогенов происходит разрыв связей с образованием радикалов (свободных атомов). Такой радикал реагирует с углеводородом с образованием свободного алкильного радикала и галогеноводорода, а далее реакция протекает по цепному механизму (разд. 5.4). Сущность цепного механизма заключается в постоянном воссоздании активных частиц, способствующих превращению все новых и новых молекул реагирующего вещества. Например, хлорирование метана происходит следующим образом:

В результате постепенного замещения атомов водорода образуется смесь различных хлорпроизводных метана: СН3С1 - хлор-метан (хлористый метил), СН2С12 - дихлорметан (хлористый метилен), СНС1з - трихлорметан (хлороформ), СС14 - тетрахлор-метан (четыреххлористый углерод).
Подобно метану могут хлорироваться и другие алканы. Причем лучше всего радикальное замещение атомов водорода идет у третичного атома углерода, затем у вторичного и в последнюю очередь - у первичного. Например:
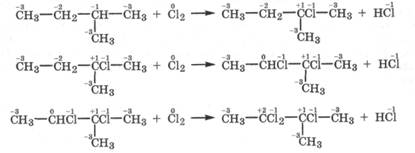
Это объясняется различием в энергии связи атома водорода с первичным (406 кДж/моль), вторичным (394 кДж/моль) и третичным (375 кДж/моль) атомами углерода, что способствует возникновению радикала прежде всего по третичному атому углерода. Как видно из реакции хлорирования, чем менее отрицательна степень окисления атома углерода в алканах, тем лучше он выступает восстановителем. Данный факт свидетельствует о том, что окислительно-восстановительные свойства углеродных атомов в органических соединениях зависят не только от их степени окисления, но и от энергетики процесса в целом.
Алканы очень активно взаимодействуют с фтором (со взрывом). Взаимодействие с бромом происходит только при освещении и нагревании. Иод с алканами не реагирует.
 |
Окисление алканов азотной кислотой. Как было установлено М. И. Коноваловым (1889), алканы взаимодействуют с разбавленной азотной кислотой при температуре 140 °С под давлением. При этом образуются нитроалканы:
Свободные радикалы возникают в результате термического расщепления азотной кислоты:
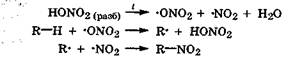
Более активным радикалом в этом процессе является  Окисление алканов кислородом. Алканы при обычных условиях устойчивы к действию кислорода и таких окислителей, как КМп04 или хромовая смесь. Однако при поджигании их на воздухе они легко сгорают с образованием С02 и Н20, т. е. разрываются все связи С-Н и С-С:
Окисление алканов кислородом. Алканы при обычных условиях устойчивы к действию кислорода и таких окислителей, как КМп04 или хромовая смесь. Однако при поджигании их на воздухе они легко сгорают с образованием С02 и Н20, т. е. разрываются все связи С-Н и С-С:

При этом выделяется большое количество теплоты (около 50 000 кДж/кг), и поэтому алканы используются в качестве топлива. Смеси газообразных и парообразных алканов с воздухом или кислородом взрывоопасны.
Окисление алканов кислородом воздуха в более мягких условиях и в присутствии специальных катализаторов может привести к образованию различных кислородсодержащих веществ: спиртов, альдегидов, кетонов, кислот, т. е. продуктов неполного окисления:

Процессы неполного окисления алканов имеют важное промышленное значение, так как позволяют получать разнообразные полезные вещества.
Особенности биологического окисления. Окисление углеводородных заместителей субстрата в организме происходит по двум механизмам: гетеролитическому, осуществляемому в субстрат-ферментном комплексе, и гомолитическому - при свободнорадикальном окислении субстрата. Ферментативный путь окисления многостадиен и строго контролируется организмом на каждой стадии. Интенсивность свободнорадикального окисления регулируется антиоксидантной системой, при этом расходуются активные метаболиты организма (разд. 9.3.9).
Ферментативное окисление углеводородных заместителей осуществляется в основном в митохондриях, где при участии кислорода происходит их дегидрирование (разд. 9.3.6), и при микросо мальном окислении, сопровождаемом гидроксилированием субстрата по связи С—Н (разд. 9.3.8).
Дегидрогеназное окисление субстрата в митохондриях. В субстрате с углеводородным заместителем, образовавшим комплекс с дегидрогеназой и ее коферментом, возникает реакционный центр, в котором происходит гетеролиз двух соседних С-Н связей. Окисляясь, субстрат отдает два протона во внутриклеточную среду; при этом в реакционном центре остаются четыре электрона: два из них образуют π-связь между углеродными атомами, а два электрона отдаются коферменту. Переходя в восстановленную форму, большинство коферментов получают необходимые два протона из внутриклеточной среды. В случае НАД+ принимается только один атом водорода, причем непосредственно связанный с углеродным атомом окисляемого субстрата. Образовавшаяся восстановленная форма кофермента сразу окисляется соседним компонентом ферментативного ансамбля элек-тронотранспортной цепи. Так повторяется, пока цитохромокси-даза не передаст электроны кислороду, который, присоединяя одновременно протоны, превращается в воду. Окисление субстрата в митохондриях сопряжено с синтезом АТФ (разд. 9.3.6).
Монооксигеназное окисление. В мембранах клеток печени или коры надпочечников с помощью ансамбля ферментов на основе цитохрома Р-450 и молекулярного кислорода происходит окисление связи С—Н углеводородного заместителя субстрата (разд. 9.3.8).
Монооксигеназное окисление углеводородного заместителя является первой стадией выведения чужеродного органического вещества (ксенобиотика) из организма. Это связано с повышением гидрофильности субстрата-ксенобиотика вследствие появления у него новой гидроксильной группы.
Свободнорадикальное окисление. Под действием кислорода 02 и его активных форм "О" (разд. 9.3.9) соединения, содержащие С-Н связи, образуют по свободнорадикальному механизму гидропероксиды или кислородсодержащие продукты их дальнейшего превращения:

При нормальной интенсивности своооднорадикальное окисление является метаболически необходимым. В случае, когда интенсивность образования радикалов и их концентрация в клетке превысят определенный предел, свободнорадикальное окисление может сдерживаться многокомпонентной антиоксидантной буферной системой организма (разд. 9.3.9).
Термические превращения алканов. При температуре выше 500 °С алканы становятся нестабильными и в их молекулах происходит разрыв связей С-Н и С-С. Этот процесс называется термическим крекингом. При крекинге алканов образуются насыщенные и ненасыщенные углеводороды с более низкой молекулярной массой и молекулярный водород:
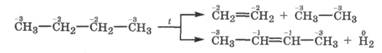
Труднее всего происходит крекинг метана:

Термическое превращение алканов (крекинг) является реакцией внутримолекулярного окисления-восстановления (дисмутации), о чем свидетельствует изменение степени окисления углеродных и водородных атомов.
В присутствии катализатора (AI2O3, SiO2 или оксиды металлов) снижается необходимая для крекинга температура, а разрыв связей в алканах может протекать не только по гемолитическому (свободнорадикальному), но и по гетеролитическому (электрофильно-нуклеофильному) механизму. В этом заключается отличие каталитического крекинга от термического.
Изомеризация алканов. В присутствии катализаторов, проявляющих сильные электрофильные свойства (галогениды и оксиды металлов или сверхкислоты BF3+HF; SbF5+HF), прямоцепочечные алканы превращаются в изо- или циклоалканы, т. е. происходит изомеризация углеродного скелета. Изомеризация алканов возможна начиная с бутана. Чем больше углеродных атомов в молекуле алкана, тем легче идет изомеризация:

Изомеризация углеродного скелета алкана сопровождается изменением степеней окисления его атомов, следовательно, реакции изомеризации также относятся к внутримолекулярным окислительно-восстановительным.
Особенности химических свойств циклоалканов. Циклоалканы являются насыщенными углеводородами с циклической структурой углеродного скелета. Их общая формула СnН2n. Циклоалканы легко вступают в радикальные реакции замещения. Исключение составляют низшие циклоалканы. Циклопропан и циклобутан относятся к напряженным системам, так как в них наблюдается уменьшение углов связей С—С—С и увеличение углов Н—С—Н по сравнению с тетраэдрическим углом. Поэтому эти циклоалканы в реакциях способны как к замещению атомов водорода, так и к разрыву связи С-С с раскрытием цикла и присоединением реагента к атомам углерода по освободившимся валентностям. Второе направление реакции присоединения наиболее характерно для циклопропана, где цикл более напряжен:

Галогенирование пяти- и шестичленных циклоалканов, построенных практически без напряжения, протекает по пути замещения атомов водорода с сохранением циклической структуры. Поскольку трех- и четырехчленные кольца циклоалканов термодинамически нестабильны, то они редко встречаются в природных соединениях.
Применение алканов. Алканы являются не только топливом, но и исходным сырьем для химической промышленности. При разгонке нефти получают несколько фракций: бензин (Ткип 40-180 °С, углеводороды С6-С10), керосин (Tкип 180-230 °С, С11-С14), дизельное топливо (Ткип 230-305 °С, С14-С17). Остается мазут, из которого перегонкой в вакууме или с водяным паром получают соляровое масло (С18-С25), смазочные масла (С28_С38), вазелин, твердый парафин (в основном, прямоцепочечные углеводороды). Высшие фракции разгонки нефти подвергают крекингу или изомеризации для получения высокосортных бензинов и алкенов (этен, пропен, бутены - важнейшее сырье для химической промышленности). В последнее время парафины нефти подвергают микробиологической обработке некоторыми микроорганизмами, что позволяет получать из нефти белковое сырье.
Нефть, попадая по различным причинам в водоемы, остается на их поверхности и, препятствуя растворению воздуха в водоемах, вызывает необратимое нарушение экологического баланса. Другая экологическая проблема возникает из-за применения тетраэтилсвинца Рb(С2Н6)4 (ТЭС) в качестве антидетонационной добавки к низкосортным бензинам (менее 5 %). Вследствие этого окружающая среда засоряется свинцом и его оксидами (разд. 14.1.4). В настоящее время ТЭС постепенно заменяется соединениями марганца - менее токсичными антидетонаторами.
В медицинской практике низшие алканы используются для местной анестезии, а циклопропан - для общего наркоза (разд. 11.4). Углеводороды широко применяются в качестве растворителей в процессах экстракции природных веществ -жиров, эфирных масел. На основе вазелинового масла и вазелина приготавливают различные лекарственные препараты для наружного применения, так как алканы, хорошо растворяясь в жирах, легко проникают через кожу.
Дата публикования: 2014-10-16; Прочитано: 5391 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
