 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Ароматические углеводороды (арены)
|
|
Простейшим ароматическим углеводородом является бензол С6Н6. Бензол имеет циклическое строение и содержит в цикле три сопряженные двойные связи, образующие единую делока-лизованную шестиэлектронную π-систему, которая называется ароматической (разд. 2.1.3). В последнее время название ароматические углеводороды заменяют на арены, а ароматические соединения - на производные аренов.
Углеводороды бензольного ряда рассматриваются как продукты замещения атомов водорода в бензольном ядре на группы - алкильные, алкенильные и др.

Двузамещенные бензолы образуют три изомера в зависимости от положения заместителей: орто-, мета- и пара-производные (сокращенно о-, м- и π -) или 1,2-, 1,3-, 1,4-замещенные бензолы соответственно. Если бензольное кольцо рассматривается как заместитель C6H5—, то его называют фенил. Для группировки С6Н5СН2— обычно используют название бензил.
Химические свойства. Бензол вступает в электрофильные реакции, но поскольку его электронная система плохо поляризуется сама и плохо поляризует реагент, то для активации реагента обычно требуется катализатор. Однако вследствие устойчивости сопряженной π-системы бензола энергия ароматизации которой составляет около 150 кДж/моль, он вступает не в реакции электрофильного присоединения (АЕ), характерные для ненасыщенных соединений, а в реакции электрофильного замещения (SE) атомов водорода. Такой механизм реакции позволяет сохранить ароматическую систему у ее продуктов. В то же время бензол может вступать в реакции свободнорадикального присоединения (AR).
Реакции электрофильного замещения. Рассмотрим механизм электрофильного замещения на примере бензола. При взаимодействии бензола с активным электрофилом (Е+), образовавшимся под воздействием катализатора, первоначально возникает π-комплекс, который медленно превращается в новую промежуточную частицу -  -комплекс. В
-комплекс. В  -комплексе один атом углерода из-за связи с электрофилом находится в состоянии sр3-гибридизации, поэтому он не участвует в сопряжении, нарушая ароматичность π-системы.
-комплексе один атом углерода из-за связи с электрофилом находится в состоянии sр3-гибридизации, поэтому он не участвует в сопряжении, нарушая ароматичность π-системы.  -Комплекс - частица малостабильная, поэтому он быстро перегруппировывается в новый л-комплекс, который отщепляет протон и превращается в замещенный бензол:
-Комплекс - частица малостабильная, поэтому он быстро перегруппировывается в новый л-комплекс, который отщепляет протон и превращается в замещенный бензол:
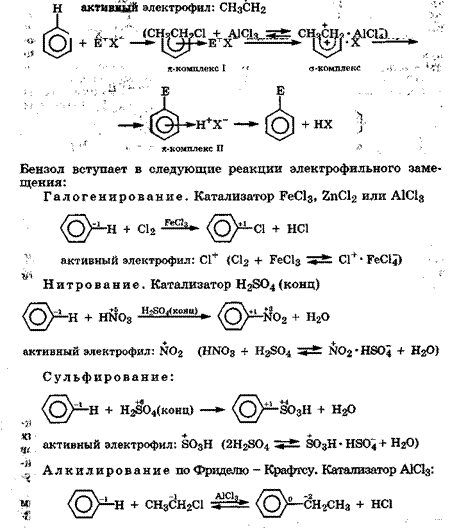 |
Для алкилирования аренов можно использовать не только гало геналканы, но и алкены или спирты, которые в присутствии кислот образуют карбкатионы (электрофилы):

Все эти реакции электрофильного замещения являются меж молекулярными окислительно-восстановительными реакциями, в которых реагент-электрофил выступает окислителем, а атом углерода арена - восстановителем.
Ориентирующее действие заместителей в бензольном ядре. Реакция электрофильного замещения может протекать глубже, приводя к образованию ди- и полизамещенных бензолов. При этом имеющийся в бензольном цикле заместитель, существенно влияя на π-электронную систему и на образование π- и 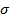 -комплексов, направляет (ориентирует) вступающую группу относительно себя в о-, га- или м-положение.
-комплексов, направляет (ориентирует) вступающую группу относительно себя в о-, га- или м-положение.
Электронодонорные заместители увеличивают электронную плотность
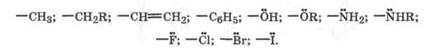 |
ароматической системы по + I- или + М-эффекту (<-D или
 соответственно), облегчая образование π-комплекса. Они также способствуют образованию
соответственно), облегчая образование π-комплекса. Они также способствуют образованию 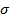 -комплекса с о- или n-ориентацией, поскольку при этом достигается дополнительная делокализация положительного заряда заместителя D. Заместители, ориентирующие электрофильное замещение в о- и n-положения, называют ориентантами первого рода. К ним относятся:
-комплекса с о- или n-ориентацией, поскольку при этом достигается дополнительная делокализация положительного заряда заместителя D. Заместители, ориентирующие электрофильное замещение в о- и n-положения, называют ориентантами первого рода. К ним относятся:
 |
Ориентанты первого рода (за исключением атомов галогенов) не только направляют электрофильное замещение в о- и n-положения, но и ускоряют его. В случае галогенбензолов реакции SE замедляются, так как атомы галогенов имеют наряду с +М-эффектом также значительный –I -эффект.
 |
Электроноакцепторные заместители (—>А), уменьшая электронную плотность ароматической системы, сильно затрудняют образование π-комплекса и способствуют образованию
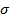 -комплекса с м - ориентацией. Заместители, ориентирующие электрофильное замещение в м-положение, называют ориентантами второго рода. К ним относятся:
-комплекса с м - ориентацией. Заместители, ориентирующие электрофильное замещение в м-положение, называют ориентантами второго рода. К ним относятся:
 |
Ориентанты второго рода не только направляют электрофильное замещение в м-положение, но и замедляют его.
 |
Реакции присоединения. Реакции присоединения к бензолу протекают по свободнорадикальному механизму и относятся к реакциям Ar. В результате этих реакций происходит необратимое разрушение π-электронной системы молекулы бензола. В качестве примеров можно привести высокотемпературное гидрирование на пористом никеле (никель Ренея), хлорирование под действием УФ-облучения и озонирование в водной среде:
Во всех этих случаях продукты реакции не имеют ароматической системы, а при озонировании происходит даже разрушение цикла.
Окисление кислородом и биологическое окисление. К окислению кислородом, перманганатом и дихроматом калия бензол при обычных условиях устойчив. В условиях организма бензол, в отличие от своих ближайших гомологов - толуола и ксилолов, чрезвычайно устойчив к биологическому окислению, поэтому он накапливается в организме, т. е. является кумулятивным ядом и очень токсичен, особенно для женщин.
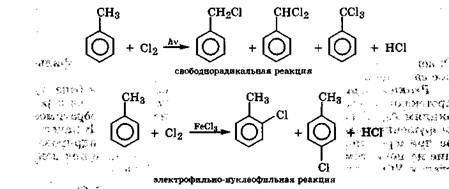 |
Для гомологов бензола характерны реакции электрофильно-го замещения (SE) в бензольное кольцо и радикального замещения (Sr) в боковую алкильную цепь, причем в первую очередь по углеродному атому, непосредственно связанному с бензольным кольцом. Так, хлорирование или бромирование толуола при нагревании и интенсивном УФ-облучении происходит исключительно в боковую цепь, как реакция свободнорадикального замещения Sr. В то же время хлорирование толуола в присутствии катализатора FeCl3 протекает исключительно как реакция электрофильного замещения SE:
Этот пример еще раз наглядно показывает, что изменение механизма реакции сопровождается изменением ее продуктов. В условиях организма изменение механизма биохимических реакций замещения может происходить вследствие УФ-облучения, радиации, а также избыточного свободнорадикального окисления.
Окисление гомологов бензола кислородом, перманганатом, дихроматом или биологическое окисление происходит по атому углерода, непосредственно связанному с бензольным кольцом. В случае моноалкилпроизводных бензола образуется бензойная кислота, а в случае о-, м- или n-диалкилпроизводных бензола - соответствующие фталевые кислоты:
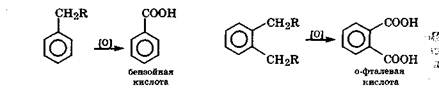
Именно способность окисляться резко снижает токсичность гомологов бензола по сравнению с самим бензолом.
Кислород окисляет бензол лишь при температуре 450 °С в присутствии катализатора (V2O5), при этом образуется малеиновый ангидрид - сырье для производства некоторых пластмасс:
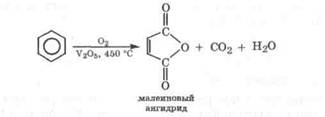
По аналогии с этой реакцией предполагают, что в организме с помощью диоксигеназ может происходить окисление бензола в малеиновую кислоту (разд. 9.3.8).
Особенности химических свойств конденсированных аналогов бензола. Особенности этого класса ароматических соединений рассмотрим на примере простейшего представителя - нафталина С10Н8:

Молекулу нафталина нельзя рассматривать как две независимые бензольные системы, так как в его молекуле  -связи более локализованы, чем в бензоле. В частности, длина а, Р-связи меньше длины связи в бензоле, а длина B,B-связи — больше.
-связи более локализованы, чем в бензоле. В частности, длина а, Р-связи меньше длины связи в бензоле, а длина B,B-связи — больше.
Для нафталина типичны реакции электрофильного замещения, которые протекают легче, чем у бензола, при этом преимущественно образуется а-изомер:

При повышенной температуре (более 100 °С) реакции замещения сопровождаются образованием заметных количеств B-изомера, который термодинамически более устойчив.
Для нафталина характерны также реакции присоединения. Так, при каталитическом гидрировании легко получается тетрагидронафталин (тетралин). В более жестких условиях идет дальнейшее гидрирование до декалина:
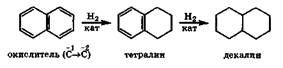
Из приведенных примеров видно, что все эти реакции окислительно-восстановительные, причем атомы углерода в нафталине, имеющие степень окисления -1, могут проявлять свойства и восстановителя, и окислителя в зависимости от реагента.
Нафталин, в отличие от бензола, довольно легко окисляется различными кислородсодержащими окислителями. Конечным продуктом этого окисления является ортофталевая кислота:
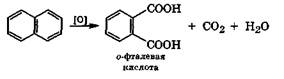
Легкость окисления конденсированных аналогов бензола объясняет сильные канцерогенные свойства бензпирена, который в заметных концентрациях присутствует в табачном дыме и выхлопных газах автомобилей. В молекуле бензпирена связь С3—С4 склонна к ферментативному окисному присоединению с образованием оксида, который, присоединяя воду, переходит в гликоль, имеющий активную к окислительному присоединению связь С1— С2:

Образующийся новый оксид имеет большую склонность к присоединению аминогруппы гуанина (Г-NН2), входящего в состав ДНК. В результате происходят необратимые изменения в молекуле ДНК, вызывающие образование раковых клеток.
Таким образом, химические свойства углеводородов различны. Для алканов, из-за наличия в молекулах только 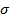 -связи, характерны реакции свободнорадикального замещения атомов водорода SR, а также термического распада и изомеризации. Их биологическое окисление может протекать с помощью дегидрогеназ (дегидрирование) и монооксигеназ (гидроксилирование), а также путем свободнорадикального окисления.
-связи, характерны реакции свободнорадикального замещения атомов водорода SR, а также термического распада и изомеризации. Их биологическое окисление может протекать с помощью дегидрогеназ (дегидрирование) и монооксигеназ (гидроксилирование), а также путем свободнорадикального окисления.
Для алкенов, из-за наличия в молекулах двойной связи, характерны реакции электрофильного присоединения Ае, а их биологическое окисление в присутствии ферментов происходит многоступенчато, включая стадии окисного присоединения по двойной связи и гидратации полученного продукта. Другой путь биологического окисления: вначале ферментативная гидратация двойной связи, а затем дегидрогеназное окисление полученного спирта в карбонилсодержащие метаболиты. Кроме того, алкены подвергаются свободнорадикальному окислению.
Для ароматических углеводородов, вследствие устойчивости циклической сопряженной системы, характерны реакции электрофильного замещения SE. В то же время в условиях образования радикалов арены вступают в реакцию свободнорадикального присоединения AR. К биологическому окислению бензол устойчив, в отличие от его гомологов, которые легко окисляются в организме. Конденсированные аналоги бензола также легко окисляются, причем склонны к ферментативному окисному присоединению с последующей гидратацией или аминированием.
 |
Дата публикования: 2014-10-16; Прочитано: 7578 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
