 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Алкенов и диенов
|
|
Алкены - непредельные углеводороды, содержащие одну двойную связь. Простейшим представителем является этен (этилен) СН2=СН2- Гомологический ряд алкенов выражается общей формулой СnН2n- Исторически сложившееся название этих углеводородов - олефины или ненасыщенные, так как они способны присоединять различные реагенты. По международной номенклатуре названия алкенов образуют от названия соответствующих алканов, заменяя суффикс -ан на -ен, причем после этого суффикса ставят цифру, обозначающую номер атома углерода. Для алкенов характерна структурная изомерия, связанная с положением двойной связи в цепи (разд. 15.2).
Углеродные атомы, связанные двойной связью, находятся в состоянии sp2-гибридизации (разд. 2.1.3). Три sр2-гибридные орбитали лежат в одной плоскости под углом 120° и образуют три прочные  -связи. Электронные облака негибридизованных (чистых) р-орбиталей этих углеродных атомов, расположенные перпендикулярно плоскости 777ст-связей, перекрываются, образуя между этими атомами л-связь. Прочность л-связи меньше, чем 0-связи. Вращение заместителей вокруг двойной связи невозможно без ее разрыва. Поэтому для алкенов характерно существование конфигурационных (геометрических) изомеров, известных под названием цис- и трансизомеров (разд. 15.2).
-связи. Электронные облака негибридизованных (чистых) р-орбиталей этих углеродных атомов, расположенные перпендикулярно плоскости 777ст-связей, перекрываются, образуя между этими атомами л-связь. Прочность л-связи меньше, чем 0-связи. Вращение заместителей вокруг двойной связи невозможно без ее разрыва. Поэтому для алкенов характерно существование конфигурационных (геометрических) изомеров, известных под названием цис- и трансизомеров (разд. 15.2).
Алкены по физико-химическим свойствам, включая гидрофобность, близки к алканам. Первые три гомолога - газы, от С5 до C17 - жидкости, а от C18 и выше - твердые вещества. Однако температуры кипения алкенов ниже, чем у соответствующих алканов, что объясняется наличием двойной связи, которая создает стерические затруднения сближению молекул и ослабляет межмолекулярные взаимодействия. Подобно алканам низшие алкены, попадая в организм, проявляют наркотический эффект.
Химические свойства алкенов. Химические свойства алкенов определяются наличием двойной связи, содержащей π -алектроны. Характерной особенностью π-электронов является их подвижность, так как они менее прочно удерживаются ядрами атомов, чем  -электроны. В результате двойная связь легко поляризуема и обладает электронодонорными свойствами, т. е. является нуклеофилом. Поэтому алкены склонны взаимодействовать с электрофилами и для них характерны реакции присоединения по двойной связи без разрушения углеродного скелета.
-электроны. В результате двойная связь легко поляризуема и обладает электронодонорными свойствами, т. е. является нуклеофилом. Поэтому алкены склонны взаимодействовать с электрофилами и для них характерны реакции присоединения по двойной связи без разрушения углеродного скелета.
Реакции присоединения. Реакции присоединения к алкенам в основном протекают по гетеролитическому (электрофильно-нуклео-фильному) механизму и являются реакциями электрофильного присоединения AE, так как инициируются электрофилами.
Галогенирование. Алкены в обычных условиях присоединяют галогены. Молекула галогена под действием π-электронов алкена поляризуется, и один из ее атомов, приобретая частичный положительный заряд, становится электрофилом и захватывается π-электронами (π-комплекс). В л-комплексе происходит дальнейшая поляризация и гетеролитическое расщепление связи галоген - галоген. В результате возникают галогенид-анион и циклический катион галогенония, которые взаимодействуют с образованием дигалогенпроизводного. Так, при взаимодействии алкенов с бромом в водной среде (бромная вода) при обычной температуре происходит обесцвечивание бромной воды за счет присоединения брома к алкену. Эта реакция является качественной на наличие двойной связи в соединениях:

Галогенирование алкенов является реакцией межмолекулярного окисления, в которой алкены за счет углеродных атомов двойной связи проявляют восстановительные свойства (2С-2 -- 2е- - -> 2С-1). Противоположные свойства алкены проявляют в реакции гидрирования.
Гидрирование. Алкены гидрируются в присутствии катализатора (Pt, Pd, Ni), превращаясь в алканы:
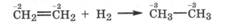
При этом они проявляют окислительные свойства за счет углеродных атомов двойной связи (2С-2 + 2е- -> 2С-3). Таким образом, алкены могут быть и восстановителями, и окислителями в зависимости от свойств реагента. Особый интерес представляют реакции присоединения к алкенам полярных молекул НХ (НВг, Н20) и с позиции направления присоединения реагента к несимметричным алкенам, и с позиции окислительно-восстановительных свойств соответствующих атомов углерода.
 |
Гидрогалогенирование. В молекулах галогеноводоро-дов связь сильнополярна, и при реакции с алкенами они выступают донорами протона. Легкость присоединения галогено-водорода определяется силой кислоты, и поэтому реакционная способность галогеноводорода возрастает в следующем ряду:
Реакция начинается с присоединения по двойной связи электрофильной частицы - протона с образованием карбкатиона, который далее присоединяет галогенид-анион:

Как видно по изменению степеней окисления атомов углерода, реакция присоединения галогеноводорода к алкенам является реакцией самоокисления-самовосстановления (дисмутации).
Присоединение галогеноводорода к этену или симметрично замещенным алкенам приводит к единственному продукту, а в случае несимметрично замещенных алкенов оно протекает согласно правилу В. В. Марковникова:
При присоединении к несимметричным алкенам полярных реагентов типа НХ электрофильная частица протон (Н+) присоединяется к более гидрогенизированному атому углерода, а анион X- - к менее гидрогенизированному атому углерода двойной связи.
Это правило учитывает взаимное влияние атомов в молекуле. Например, в пропене за счет положительного индуктивного эффекта метильной группы происходит поляризация двойной связи, при которой наиболее гидрогенизированный ее углеродный атом имеет частичный отрицательный заряд, и поэтому именно он присоединяет протон:

К подобному выводу приводит и учет степени окисления углеродных атомов двойной связи, так как наиболее гидрогенизированный атом углерода имеет более отрицательную степень окисления, что способствует присоединению им электрофила - протона.
Присоединение бромоводорода к пропену с образованием 2-бромпропана происходит, если реакция проводится в темноте и в отсутствие источника свободных радикалов, т. е. когда имеет место электрофильно-нуклеофильный механизм присоединения реагента. При проведении этой реакции на свету или в присутствии Н202, или даже кислорода воздуха, т. е. в условиях, способствующих гемолитическому распаду НВr на свободные радикалы, реакция присоединения протекает иначе. В этих условиях присоединение происходит по свободнорадикальному механизму (Ar). Направление присоединения свободного радикала к молекуле несимметричного алкена зависит от стабильности образующегося алкильного радикала. Последний тем стабильнее, чем больше связей с другими атомами углерода имеет его атом углерода с неспаренным электроном. Поэтому присоединение НВr к пропену, когда атакующей частицей является свободный радикал Вг*, происходит с образованием 1-бромпропана:
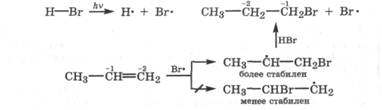
Следовательно, результат присоединения НВг к пропену зависит от механизма реакции. При электрофильно-нуклеофильном механизме образуется 2-бромпропан, а по свободнорадикальному механизму - 1-бромпропан. Это наглядный пример влияния механизма реакции на строение образующегося продукта. К тому же этот пример показывает, что может произойти с биохимической реакцией присоединения при появлении в организме свободных радикалов вследствие радиационного облучения или даже свободнорадикального окисления.
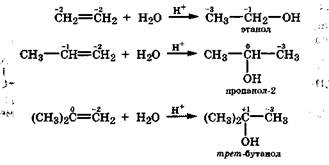
Гидратация. Поскольку вода является слабым донором протона, то ее присоединение к алкенам возможно только в присутствии катализатора - кислоты. Присоединение воды к несимметричным алкенам происходит в соответствии с правилом Марковникова. В зависимости от строения алкена могут получаться первичные, вторичные и третичные спирты:
В случае присоединения полярных реагентов типа НХ к алкенам с электроотрицательной группой Y = —СООН, —CN, — N02 электрофильная частица Н+ оказывается у  -углеродного атома, а нуклеофильная частица Х- у B-углеродного атома двойной связи:
-углеродного атома, а нуклеофильная частица Х- у B-углеродного атома двойной связи:
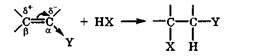
Например, при гидратации а, Р-ненасыщенных карбоновых кислот в кислой среде образуются р-гидроксикарбоновые кислоты.
Эта реакция является одной из стадий процесса B-окисления жирных кислот в организме (разд. 19.4.2).
Полимеризация. Для алкенов характерны реакции полимеризации.
Полимеризация - реакция последовательного присоединения молекул с кратной связью к активному центру, находящемуся на конце растущей цепи, приводящая к получению высокомолекулярного соединения.
Исходное вещество называется мономером, а продукт реакции - полимером. Реакцию полимеризации алкенов можно выразить общим уравнением:
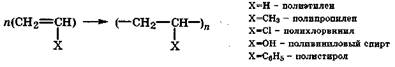
Реакции полимеризации могут протекать по двум механизмам: свободнорадикальному и электрофильно-нуклеофильному (ионному). В зависимости от давления, температуры, катализатора один и тот же мономер может полимеризоваться по тому или иному механизму. Полимеризация по свободнорадикальному механизму начинается и развивается под действием радикалов и приводит к образованию нестереорегулярных полимеров:
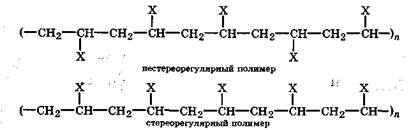
Полимеризация по электрофильно-нуклеофильному механизму начинается, в зависимости от свойств мономера и катализатора, с возникновения в реакционной системе электрофила (катиона) или нуклеофила (аниона). В этих случаях реакция полимеризации, Особенно с катализаторами Циглера (алюминий- и титанорганические соединения), приводит к образованию стереорегулярных полимеров. Полимеры со стереорегулярным строением всегда выгодно отличаются по свойствам от нестереорегулярных полимеров.
При реакциях полимеризации алкенов степени окисления углеродных атомов не изменяются, поэтому они не являются окислительно-восстановительными.
Окисление кислородсодержащими окислителями и биологическое окисление. Алкены, в отличие от алканов, легче подвергаются действию различных окислителей. В зависимости от условий образуются разные продукты. В жестких окисление кислородом происходит по свободнорадикальному механизму при значительной концентрации радикалов, в результате образуются СО2 и Н2О:
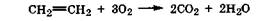
В более мягких условиях окисление идет только по двойной связи. Окисление этена разбавленным раствором КМп04 в нейтральной или слабощелочной среде приводит к образованию двухатомного спирта - этиленгликоля (реакция Вагнера, 1888):
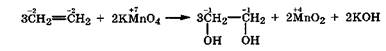
В результате этой реакции раствор КМп04 обесцвечивается, поэтому она используется как качественная реакция на наличие двойной связи в исследуемом веществе.
При действии более сильных окислителей в жестких условиях (кислотный раствор КМп04 или К2Сr2О7, а также озон О3) происходит окислительное расщепление молекулы алкена по двойной связи с образованием соответствующих кислот:

При мягком окислении этилена кислородом в присутствии катализатора происходит образование оксида этилена. Это соединение содержит напряженный трехчленный цикл и поэтому, подобно циклопропану, легко вступает в реакции присоединения полярных реагентов Н2О, NH3, НСl:
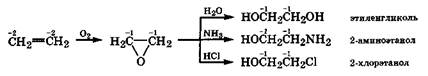
Биологическое ферментативное окисление соединений с двойной межуглеродной связью довольно часто идет через стадию ферментного окисного присоединения с образованием неустойчивого оксида, который очень легко присоединяет воду или амины, трансформируясь в более устойчивые метаболиты:
Существует еще один путь ферментативного окисления алкенов. Вначале идет ферментативное присоединение воды с последующим ферментативным дегидрированием (окислением) полученного продукта с образованием карбонилсодержащих метаболитов:

Этот путь имеет место при B-окислении жирных кислот в организме (разд.19.4.2).
Наряду с ферментативным окислением алкены подвергаются свободнорадикальному окислению. Окисление идет по углеродному атому, находящемуся рядом с двойной связью, поскольку при этом образуется энергетически выгодный аллильный радикал. Свободный аллильный радикал под действием кислорода и воды легко превращается в гидропероксид и свободный радикал 

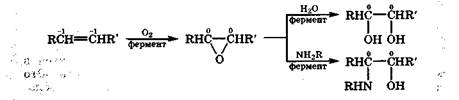 |
Дальнейший распад гидропероксида до карбоновых кислот рассмотрен в разд. 9.3.9. Такой путь окисления называют автоокислением, и он лежит в основе пероксидного окисления липидов, содержащих ненасыщенные жирные кислоты, с образованием из них карбоновых кислот с более короткой углеводородной цепью (разд. 20.1). Автоокисление часто бывает причиной порчи пищевых продуктов при хранении. За счет автоокисления на воздухе высыхают масляные краски, так как под действием кислорода происходит радикальная полимеризация их ненасыщенной масляной основы.
Особенности строения и химических свойств сопряженных алкадиенов. Алкадиены - непредельные углеводороды, содержащие две двойные связи в углеродной цепи. Наибольшее практическое значение имеют алкадиены с сопряженными двойными связями, которые разделены одной простой С—С связью, например:

В молекуле бутадиена-1,3 все атомы углерода находятся в состоянии sр2-гибридизации и лежат в одной плоскости. Это способствует взаимодействию подвижных π-электронных облаков двух соседних связей, т. е. π, π-сопряжению, приводящему к делокализации электронной плотности с возникновением единого  -электронного облака, охватывающего все четыре атома углерода (разд. 2.1.3). Поэтому сопряженную систему в бута-диене-1,3 надо рассматривать как одно целое, а не как простую комбинацию двух двойных связей.
-электронного облака, охватывающего все четыре атома углерода (разд. 2.1.3). Поэтому сопряженную систему в бута-диене-1,3 надо рассматривать как одно целое, а не как простую комбинацию двух двойных связей.
Реакция присоединения. Наличие π, π-сопряжения у алкадиенов-1,3 проявляется в их реакциях присоединения, которые идут в двух направлениях: 1,2- и 1,4-присоединение. Это происходит из-за делокализации положительного заряда в промежуточном карбкатионе. Соотношение изомерных продуктов присоединения определяется температурой реакции, полярностью растворителя, характером реагента. Рассмотрим реакцию бромирования бутадиена-1,3:
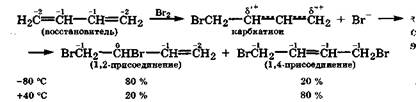
При низкой температуре в основном образуется продукт 1,2-при-соединения, поскольку скорость его образования выше. При высокой температуре преобладает продукт 1,4-присоединения, так как он термодинамически более стабилен.
Алкадиены, подобно алкенам, при галогенировании выступают восстановителями, при гидрировании - окислителями, а при гидрогалогенировании происходит окисление одного и восстановление другого атома углерода при двойных связях:

Полимеризация. Алкадиены-1,3 легко полимеризуются, главным образом, по пути 1,4-присоединения. Полимеризация алкадиенов-1,3, в зависимости от условий и природы катализатора, может протекать по свободнорадикальному или электрофильно-нуклеофильному (ионному) механизму. В результате образуются широко используемые полимеры - каучуки:
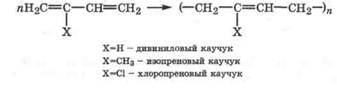 |
Производство синтетического каучука из дивинила впервые было разработано и организовано в промышленных масштабах С. В. Лебедевым (1930) в России. Первоначально полимеризацию проводили по свободнорадикальному механизму, поэтому получали нестереорегулярные каучуки. В настоящее время на катализаторах Циглера - Натта получают стереорегулярные каучуки, которые выгодно отличаются своими свойствами. Натуральный каучук представляет собой стереорегулярный полимер изопрена с молекулярной массой от 5000 до 300 000.
Существует большая группа углеводородов общей формулы (С5Н8)2n которые называются терпены и рассматриваются как продукты ди-, тетра- или гексамеризации изопрена C5H8- Терпены могут иметь ациклическое или циклическое (би-, три- и полициклическое) строение. При соединении молекул изопрена в терпены некоторые двойные связи могут исчезать или изменять свое положение, что следует учитывать при знакомстве с соединениями этого ряда. В качестве примера приведем монотерпены С10Н16 - мирцен и лимонен:
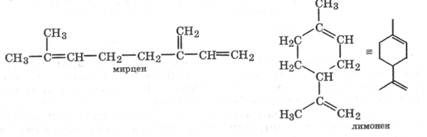
Терпены содержатся в высших растениях, ими богаты смола хвойных деревьев, сок каучуконосов. Так, мирцен содержится в эфирных маслах хмеля и благородного лавра, а лимонен - в живице сосны, цитрусовых плодах, мяте и других растениях. Примером смеси терпенов является широко используемый скипидар -продукт перегонки смолы хвойных растений.
Кроме терпеновых углеводородов в состав эфирных масел входят их производные, содержащие спиртовые, альдегидные и кетонные группы, - терпеноиды. Среди них большое применение находят ментол (спирт), цитраль (альдегид), камфора (кетон):

Терпеновые группировки (изопреноидные цепи) входят в структуру многих сложных биологически активных соединений, таких как витамин А, абиетиновая кислота, сквален, каротиноиды, которые будут рассмотрены в разд. 20.3.
Дата публикования: 2014-10-16; Прочитано: 5515 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
