 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Классификация органических реакций и их компонентов
|
|
Реакции с участием органических соединений подчиняются тем же законам, что и реакции в неорганической химии, хотя и имеют некоторые специфические особенности. В неорганической химии в реакциях обычно участвуют ионы, поэтому они протекают очень быстро, а иногда - мгновенно. В реакциях органической химии обычно участвуют молекулы, при этом разрываются одни ковалентные связи и образуются новые. Эти реакции протекают значительно медленнее, чем ионные, и для их успешного осуществления часто необходимы жесткие условия: повышенная температура, повышенное давление и катализаторы. В отличие от неорганических, органические реакции редко приводят к высокому выходу продукта (более 80 %), так как обычно протекает не одна, а несколько реакций. Поэтому в органической химии используются не химические уравнения, а схемы реакций, в которых обычно не приводятся стехиометрические соотношения между участниками, но указываются условия проведения реакции. Например, реакция этилена с водой, протекающая при повышенной температуре, повышенном давлении и в присутствии кислотного катализатора, записывается так:

В ходе большинства биохимических реакций изменению подвергается не вся молекула органического соединения, как это обычно бывает с неорганическими веществами, а только ее часть, которая называется реакционным центром. Реакционные центры в зависимости от природы и структуры имеют разную степень сродства к атакующим частицам, и их можно подразделять в зависимости от типа органической реакции.
Реакции в органической химии принято классифицировать по механизму их протекания и по конечному результату химического превращения. По механизму протекания реакции делятся на гетеролитические (электрофильно-нуклеофильные) и гемолитические (свободнорадикалъные). Поскольку названия «электрофильно-нуклеофильные» или «свободнорадикалъные» указывают на характер реагирующих частиц, то они используются в учебнике для харатеристики механизма реакции.
Электрофильно-нуклеофильные реакции сопровождаются гетеролизом полярной ковалентной связи между фрагментами  причем так, что ее общая электронная пара сильно смесмещается к одному фрагменту молекулы
причем так, что ее общая электронная пара сильно смесмещается к одному фрагменту молекулы  , превращая его в нуклеофил, а у другого фрагмента возникает дефицит электронов
, превращая его в нуклеофил, а у другого фрагмента возникает дефицит электронов  , превращая его в электрофил:
, превращая его в электрофил:

где А и В обозначают атомы или группы атомов, связанные полярной ковалентной связью. При полном гетеролизе связь разрывается с образованием катиона А+ — сильного электрофила — и аниона В- - сильного нуклеофила. Процесс гетеролиза ковалентной связи можно рассматривать как расщепление этой связи по донорно-акцепторному механизму.
Гетеролиз ковалентной связи происходит и в молекуле субстрата, и в молекуле реагента. Результатом электрофильной реакции является взаимодействие между фрагментами реагента и субстрата, проявляющими противоположные свойства.
Электрофилами называются частицы или фрагменты молекул, содержащие свободную, доступную орбиталь и имеющие недостаток электронной плотности, которые в результате реакции образуют связь с новым нуклео-филом, акцептируя у него оба электрона на свою вакантную орбиталь.
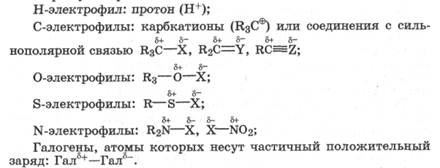 |
Электрофилами являются положительно заряженные частицы или фрагменты молекул, проявляющие высокое сродство к электронной паре нуклеофила:
В электрофильно-нуклеофильных реакциях электрофил выступает акцептором электронной пары нуклеофила. К электрофилам также относятся все кислоты (доноры протона) при кислотно-основном взаимодействии, все окислители (акцепторы электронов) при окислительно-восстановительном взаимодействии и все комплексоообразователи (акцепторы электронов) в реакциях комплексообразования.
Нуклеофилами называются частицы или фрагменты молекул, содержащие подвижную электронную пару, которые в результате реакции образуют связь с новым электрофилом, отдавая ему эту электронную пару.
 |
Нуклеофилами являются отрицательно заряженные частицы или фрагменты молекул, проявляющие высокое сродство к электрофилу:
 |
В электрофильно-нуклеофильных реакциях нуклеофил выступает донором электронной пары. К нуклеофилам также относятся все основания при кислотно-основном взаимодействии, все восстановители при окислительно-восстановительном взаимодействии и все лиганды в реакциях комплексообразования.
Таким образом, используемые в органической химии понятия электрофил и нуклеофил имеют более широкий смысл, чем понятия кислота и основание, окислитель и восстановитель, ком-плексообразователь и лиганд, используемые в неорганической химии. Однако суть электрофильно-нуклеофильных реакций, подобно кислотно-основным, окислительно-восстановительным и реакциям комплексообразования, также заключается в донорно-акцепторном взаимодействии компонентов с противоположными свойствами.
Электрофильно-нуклеофильные свойства органических соединений проявляются прежде всего в их способности вступать в реакции: кислотно-основные, окислительно-восстановительные и комплексообразования. Органические соединения вступают также и в другие электрофильно-нуклеофильные реакции, которые нельзя отнести к вышеуказанным. В основном именно для этих реакций в данном учебнике будет использоваться термин «электро-фильно-нуклеофильная реакция».
Электрофилы и нуклеофилы характеризуются различной поляризуемостью и качественно подразделяются (разд. 2.1.3) на жесткие (низкая поляризуемость) и мягкие (высокая поляризуемость).
Жесткие электрофилы имеют сравнительно большой положительный заряд, а их свободная орбиталь, на которую перейдет электронная пара нуклеофила, имеет низкий уровень энергии. Жесткими электрофилами являются:

Жесткие нуклеофилы хорошо удерживают свою электронную пару, поскольку ее орбиталь расположена близко к ядрам атомов и имеет низкий уровень энергии. Донорными атомами в жестких нуклеофилах могут быть кислород, азот, хлор, фтор. Жесткими нуклеофилами являются:

Жесткие нуклеофилы трудно окисляются.
Мягкие электрофилы содержат акцепторные атомы большого размера с невысокой электроотрицательностью и с малым положительным зарядом. Их свободная орбиталь, принимающая электронную пару нуклеофила, имеет высокий уровень энергии. Мягкими электрофилами являются:

Мягкие нуклеофилы плохо удерживают свою электронную пару, поскольку ее орбиталь удалена от ядер атомов и имеет высокий уровень энергии. Донорными атомами в мягких нуклеофилах выступают атомы серы, иода и углерода.
Мягкими нуклеофилами являются:

Мягкие нуклеофилы довольно легко окисляются. Существуют электрофилы и нуклеофилы, которые занимают промежуточное положение.

В соответствии с принципом Пирсона более стабильная связь образуется при взаимодействии жесткого электрофила с жестким нуклеофилом или мягкого электрофила с мягким нуклеофилом. На основе этого принципа можно качественно оценить реакционную способность при взаимодействии нуклеофилов и электрофилов различного типа.
В органической химии электрофильно-нуклеофильные реакции принято называть по характеру частицы, которой реагент атакует субстрат. Этот выбор можно объяснить тем, что реагент обычно является более простой молекулой, в которой проще определить состав электрофильного и нуклеофильного фрагмента и их активность, а следовательно, и характер атакующей частицы.
Нуклеофильной называется реакция, при которой реагент атакует субстрат своим нуклеофилом; она обозначается индексом N (nucleophile).

В нуклеофильных реакциях реагент принято называть нуклеофилом.
В органической химии нуклеофильность реагента характеризует его способность взаимодействовать с атомом углерода субстрата, несущим полный или частичный положительный заряд.
 |
Электрофильной называется реакция, при которой реагент атакует субстрат своим электрофилом; она обозначается индексом Е (electrophile).
В электрофильных реакциях реагент принято называть электрофилом. В органической химии электрофильность реагента характеризует его способность взаимодействовать с атомом углерода субстрата, несущим полный или частичный отрицательный заряд.
В действительности механизм и результат любой электрофильно-нуклеофильной реакции определяется не только свойствами реагента, но и свойствами субстрата, образующихся продуктов реакции, растворителя и условиями ее проведения. Поэтому разделение электрофильно-нуклеофильных реакций на нуклеофильные и электрофильные только по свойствам реагента носит условный характер. Кроме того, как видно из приведенных схем, в этих реакциях всегда взаимодействуют между собой электрофилы и нуклеофилы, содержащиеся в субстрате и реагенте. Во многих реакциях лишь условно один компонент может считаться субстратом, а другой - реагентом.
Свободнорадикальные реакции. Гомолитический распад характерен для неполярной или малополярной связи. Он сопровождается образованием свободных радикалов - частиц с неспаренным электроном (разд. 5.2.1).

Гомолиз ковалентной связи можно рассматривать как расщепление этой связи по обменному механизму. Для осуществления гомолиза связи необходима энергия (теплота, свет), достаточная для того, чтобы разорвать эту связь. Наличие неспаренного электрона является причиной малой стабильности свободных радикалов (время жизни в большинстве случаев составляет доли секунды) и высокой реакционной способности в свободнорадикальных реакциях. Присутствие в системе свободного радикала  может приводить к образованию новых радикалов вследствие его взаимодействия с имеющимися молекулами:
может приводить к образованию новых радикалов вследствие его взаимодействия с имеющимися молекулами:

Свободнорадикальные реакции сопровождаются взаимодействием свободных радикалов с молекулами или между собой с образованием новых свободных радикалов (зарождение или развитие цепи) или только молекул (обрыв цепи).
Для свободнорадикальных реакций характерен цепной механизм, который включает три стадии: зарождение, развитие и обрыв цепи (разд. 5.4). Эти реакции прекращаются при исчезновении в системе свободных радикалов. Свободнорадикальные реакции обозначаются индексом R (radical).
Радикальные частицы в зависимости от их сродства к электрону могут и принимать электроны (т. е. быть окислителями), и отдавать электроны (т. е. быть восстановителями). При этом сродство радикала к электрону определяется не только его свойствами, но и свойствами его партнера по реакции. Особенности процессов свободнорадикального окисления-восстановления, протекающих в организме, были рассмотрены в разд. 9.3.9.
В реакциях комплексообразования радикалами могут быть и комплексообразователь, и лиганды. В случае комплексов с переносом заряда радикалообразование может происходить внутри комплекса за счет внутримолекулярного окисления-восстановления между комплексообразователем и лигандом (разд. 17.4).
Образование радикалов легче всего происходит при гомолизе неполярных простых связей между атомами одного и того же элемента:

При гомолизе малополярной связи С—Н образуются алкильные радикалы, в которых неспаренный электрон находится у атома углерода. Относительная устойчивость этих радикалов зависит от типа замещения атома углерода, несущего неспаренный электрон, и растет в ряду: *СН3 < *-CI2R < *СHR2 < *CR3. Это объясняется положительным индуктивным эффектом алкильных групп, который, повышая электронную плотность на атоме углерода, способствует стабилизации радикала.
Стабильность свободных радикалов существенно возрастает, когда имеется возможность делокализации неспаренного электрона за счет π-электронов соседних кратных связей. Это особенно наглядно наблюдается в аллильном и бензильном радикалах:

В ходе ознакомления с возможными механизмами реакций в молекулах субстрата и реагента следует различать реакционные центры по их характеру: нуклеофильные, электрофильные и радикальные.
По конечному результату химического превращения простейшие органические реакции классифицируются на реакции: замещения, присоединения, элиминирования (отщепления) и перегруппировки.
Реакции замещения. Под замещением понимают замену атома или группы на другой атом или группу. В реакции замещения всегда образуются два различных продукта. Этот тип реакций обозначается символом S (substitution).
К реакциям замещения относятся: галогенирование и нитрование алканов (разд. 16.1), этерификация и алкилирование карбоновых кислот (разд. 19.2.3), а также многочисленные реакции взаимодействия простых полярных молекул (Н20, NH3, НГал) с эфирами, спиртами и галогенпроизводными (разд. 17.3, 17.5, 19.2.3).
Реакции присоединения. Под присоединением понимают введение атомов или групп в молекулу непредельного соединения, сопровождаемое разрывом π-связей. При этом двойные связи превращаются в ординарные, а тройные связи - в двойные или ординарные (разд. 16.2). Этот тип реакций обозначается символом A (addition).
Реакции элиминирования (отщепления). Под элиминированием понимают отщепление атомов или групп от органической молекулы с образованием кратной связи. Поэтому реакции элиминирования обратны реакциям присоединения. Этот тип реакции обозначается символом Е (elimination).
Каждая из органических реакций замещения (S), присоединения (А) или элиминирования (Е) может быть электрофильной (Е), нуклеофильной (N) или радикальной (R). Таким образом, в органической химии выделяют девять типовых реакций, обозначаемых символами S, А или Е с индексами R, N или Е:

 |
Приведенные типы органических реакций следует считать модельными, так как они не всегда реализуются в чистом виде. Так, например, замещение и элиминирование могут протекать одновременно:
Перегруппировки. В процессе перегруппировки происходит перемещение (миграция) одних атомов или групп ют одного фрагмента молекулы к другому без изменения ее брутто-формулы. Перегруппировки органических соединений происходят обычно в присутствии катализатора и сопровождаются окислительно-восстановительной дисмутацией атомов углерода:

При дальнейшем знакомстве с конкретными классами органических соединений нами будут рассматриваться следующие их химические свойства: кислотно-основные, комплексообразующие, окислительно-восстановительные, электрофильно-нуклеофильные, а также способность к свободнорадикальному взаимодействию. Особое внимание будет уделено особенностям протекания рассматриваемых реакций в биологических системах

Глава 16
Дата публикования: 2014-10-16; Прочитано: 3834 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
