 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Пространственная структура биоорганических молекул и виды изомерии
|
|
Многообразие органических соединений обусловлено в значительной мере явлением изомерии.
Изомерами называются соединения с одинаковым качественным и количественным составом, но отличающиеся последовательностью связывания атомов или расположением их в пространстве. Даже минимальные структурные различия между изомерами биомолекул приводят к заметным различиям в их физических и химических свойствах и очень сильно влияют на их биологическую активность. Возможны следующие типы изомерии: структурная и пространственная (стереоизомерия).
Структурная изомерия. Этот тип изомерии обусловлен различным взаимным расположением атомов в молекулах.
* Название сложных заместителей обычно заключается в скобки. Цифры в скобках относятся к нумерации боковой цепи, причем нумерация начинается с того атома углерода, который непосредственно связан с главной цепью.
При этом различают изомерию углеродного скелета и изомерию положения.
 |
Изомерия углеродного скелета обусловлена способностью атомов углерода образовывать как прямые (нормальные) углеродные цепи, так и разветвленные цепи с различной степенью разветвления. Например, у пентана имеются три изомера:
Изомерия положения обусловлена различным положением заместителей, функциональных групп или кратных связей в молекулах органических соединений одинакового состава. Например:
Для рассмотренных видов структурной изомерии взаимное превращение изомеров друг в друга при обычных условиях отсутствует. Особым случаем структурной изомерии является таутомерия.
 |
Таутомерия - явление равновесной динамической изомерии, при которой происходит быстрое обратимое самопроизвольное превращение структурных изомеров, сопровождаемое миграцией подвижной группы между двумя или несколькими центрами в молекуле.
Таутомерия свойственна соединениям, в молекулах которых имеются разные реакционноспособные группировки. Например, в молекулах природных аминокислот имеются две группы с противоположными свойствами: аминогруппа - основные свойства - и карбоксильная группа — кислотные свойства (разд. 8.2). Между этими группами осуществляется перенос протона, и поэтому такой вид изомерии называется прототропной таутомерией. Для обозначения таутомерного равновесия в учебнике использованы пунктирные стрелки.

Для всех природных аминокислот в кристаллическом состоянии и в водных растворах наиболее устойчив таутомер, имеющий структуру биполярного иона. Его содержание превышает 99,9%. Поэтому в учебнике все природные а-аминокислоты всегда изображены в виде таутоМера с биполярно-ионной структурой.
Прототропная таутомерия бывает разных видов: кетоенольная (разд. 18.2.3), лактим-лактамная (разд. 23.2) и др. Кроме прототропной таутомерии в природных соединениях наблюдается кольчато-цепная таутомерия, которая особенно характерна для углеводов (разд. 22.1).
Пространственная изомерия (стереоизомерия). Пространственная изомерия в молекуле обусловлена различным пространственным расположением атомов при одинаковом порядке их связывания.
Стереоизомеры - изомеры, имеющие одинаковую последовательность химических связей атомов, но различное расположение этих атомов относительно друг друга в пространстве.
Стереоизомеры могут различаться конформацией и конфигурацией.
онформациями молекулы называются различные ее пространственные формы, возникающие в результате вращения атомов или групп вокруг ординарных связей.
Стереоизомеры, различие между которыми обусловлено поворотом отдельных участков молекулы вокруг ординарных связей, называются конформерами. Наиболее стабильными и энергетически выгодными конформерами являются те, в которых между несвязанными атомами или их группами межатомное отталкивание наименьшее; их называют заторможенными конформерами. Конформеры, где атомы или их группы расположены близко друг к другу, являются нестабильными и называются заслоненными. Фактически различные конформеры находятся в динамическом равновесии, и возможность перехода одного конформера в другой определяется энергетическим барьером вращения, который составляет 10-50 кДж/моль. Поскольку энергетический барьер вращения невелик, то переход из одной конформаций в другую осуществляется легко, и поэтому выделить конформеры в качестве устойчивых изомеров нельзя. Внутреннее вращение вокруг простых связей ограничивается или даже затормаживается в случае высокого энергетического барьера вращения.
Для изображения результатов вращения по связи С—С удобно пользоваться проекционными формулами Ньюмена (1955). Эти проекции получают, рассматривая молекулу вдоль С—С связи, вокруг которой происходит вращение. Ближайший к наблюдателю атом углерода обозначается точкой пересечения его связей
 , а удаленный от наблюдателя атом углерода и его связи -окружностью с линиями
, а удаленный от наблюдателя атом углерода и его связи -окружностью с линиями  . На рис. 15.1 при помощи проекций Ньюмена и стереохимических формул изображено вращение метильных групп вокруг связи С—С в молекуле этана.
. На рис. 15.1 при помощи проекций Ньюмена и стереохимических формул изображено вращение метильных групп вокруг связи С—С в молекуле этана.
В длинных углеродных цепях вращение возможно вокруг нескольких С—С связей. Поэтому вся цепь может принимать разнообразные геометрические формы, среди которых зигзагообразная конформация наиболее устойчива. Именно эта кон-формация характерна для гидрофобных фрагментов природных жирных кислот и их производных.
В циклических соединениях вращение вокруг ординарных связей ограничено, что приводит к возникновению определенных

Рис. 15.1. Проекции Ньюмена и стереохимические формулы заслоненного и заторможенного конформеров молекулы этана

Рис. 15.2. Циклогексан в конформациях ванны и кресла
конформаций. В природных соединениях особенно часто встречается фрагмент, содержащий циклогексановый цикл. Атомы углерода в этом цикле находятся в состоянии sр3-гибридизации, и, следовательно, их химические связи не лежат в одной плоскости. У циклогексана возникают два конформера типа кресла и ванны (рис. 15.2). В конформаций «кресло», в отличие от конформации «ванна», не имеется заслоненных положений атомов водорода, поэтому она термодинамически более устойчива. При комнатной температуре молекулы циклогексана существуют практически только в конформаций кресла.
Производные циклогексана, содержащие два и более объемных заместителя, имеют такую конформацию, в которой эти заместители располагаются наиболее удаленно друг от друга, например по разные стороны от плоскости цикла.
Биологическое действие многих лекарственных веществ и биорегуляторов (гормоны, витамины, антибиотики и др.) тесно связано с пространственным строением их молекул. Для Наиболее полного связывания этих веществ рецепторами клетки они должны иметь определенную конформацию. Изменение конформаций, как правило, снижает степень связывания и ослабляет биологическое действие. О конформаций белков, полисахаридов и нуклеиновых кислот речь пойдет в разд. 21.4, 22.3 и 23.3.
Стереоизомеры могут отличаться не только конформацией, но и конфигурацией.
Конфигурациями молекул называются разные пространственные расположения атомов или групп, которые не могут быть переведены друг в друга простым вращением вокруг связей.
В отличие от конформационных изомеров, которые легко превращаются друг в друга, конфигурационные изомеры устойчивы. Различают два вида конфигурационной изомерии: геометрическую, или цис-транс-изомерию, и оптическую изомерию.
Геометрическая изомерия. Стереоизомеры, отличающиеся друг от друга расположением заместителей по отношению к плоскости двойной связи или цикла, называются геометрическими изомерами. Изомер, содержащий одинаковые заместители по одну сторону от плоскости связи (цикла), называется цис-изомером, а если они расположены с противоположных сторон — транс-изомером:
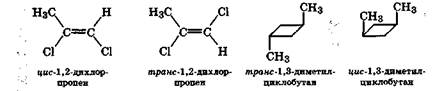
цис-транс-Изомеры отличаются друг от друга не только физическими и химическими свойствами, но и биологической активностью, на что уже было указано в разд. 10.2.
Геометрическая изомерия часто встречается среди природных соединений, в частности сопряженных полиенов. Так, ретиналь-активная форма витамина А представлена в организме в виде транс-изомера, который под действием фермента ретинальизомеразы превращается в цис-ретиналь. При поглощении света протекает фотоизомеризация цис-ретиналя обратно в транс-изомер. Эта реакция лежит в основе возбуждения палочек сетчатки глаза.

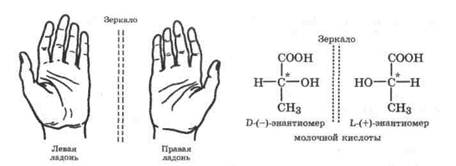
Оптическая изомерия. Она характерна для несимметричных соединений, у которых в молекуле имеется атом углерода в состоянии sр3-гибридизации, связанный с четырьмя различными атомами или группами. Такой атом углерода называется асимметрическим и обозначается С*. Оптические изомеры отличаются друг от друга как несимметричный предмет от своего изображения в зеркале, и их нельзя перевести друг в друга путем внутреннего вращения (рис. 15.3). Другими словами, изомеры L и D относятся друг к другу как левая рука к правой и они несовместимы. Это свойство называется хиральность, а асимметрический атом - хиральным центром. В большинстве случаев наличие хирального атома в молекуле уже служит указанием на ее хиральность.
У оптических изомеров физические и химические свойства идентичны, но по отношению к шюскополяризованному свету они ведут себя по-разному. Один из изомеров называется левовращающим, так как он поворачивает плоскость поляризации света на определенный угол влево (т. е. против часовой стрелки) и обозначается (—), а другой изомер - вправо на такой же угол и называется правовращающим (+). Оптические изомеры называют также оптическими антиподами или энантиомерами. Эквимолярная смесь энантиомеров называется рацематом. Рацематы оптически неактивны. Таким образом, энантиомеры одного и того же вещества не могут непосредственно перейти друг в друга, и поэтому оптическая изомерия не может иметь равновесный характер.
Хиральность характерна для всех природных аминокислот, кроме глицина, поскольку их молекулы содержат асимметричный атом углерода, вокруг которого располагаются четыре различных

Оптические изомеры а-аминокислот в соответствии с их истинной конфигурацией обозначаются буквами L и D, а по новой системе - S и R соответственно. Природные а-аминокислоты в подавляющем большинстве относятся к L(S))-энантиомерам левовращающим (-). Использование для построения белков в организме человека только L-энантиомеров имеет важнейшее значение для формирования пространственной структуры белков. С этим непосредственно связана стереоспецифичность действия ферментов. Молекулы ферментов хиральны и вступают во взаимодействие только с теми субстратами, которые также имеют определенную конфигурацию. Поэтому биологической активностью обычно обладает лишь один стереоизомер, а другие значительно менее активны или вообще неактивны.
Рис. 15.3. Хиральные объекты
 |
 15.3. ПОНЯТИЕ О ВЗАИМНОМ ВЛИЯНИИ АТОМОВ В МОЛЕКУЛЕ И ЭЛЕКТРОННЫЕ ЭФФЕКТЫ
15.3. ПОНЯТИЕ О ВЗАИМНОМ ВЛИЯНИИ АТОМОВ В МОЛЕКУЛЕ И ЭЛЕКТРОННЫЕ ЭФФЕКТЫ
Согласно теории А. М. Бутлерова свойства и реакционная способность молекулы во многом зависят от взаимного влияния атомов или групп атомов друг на друга.
В результате взаимного влияния атомов и электронов связей в молекулах происходит перераспределение электронной плотности, что вызывает изменение реакционной способности отдельных связей и молекулы в целом. Замена в соединении атома одного элемента атомом другого элемента или группой атомов приводит не только к изменению распределения электронной плотности в новой связи, но и вызывает соответствующие изменения электронных плотностей нескольких соседних связей. Различают электро-ноакцепторные (притягивающие электроны - эффект "-") и электронодонорные (посылающие электроны - эффект "+") заместители. При рассмотрении электронных смещений необходимо четко различать электронные эффекты в насыщенных системах связей и в сопряженных системах (разд. 2.1.3).
Электронные эффекты в насыщенных системах. Заместитель, вызвавший появление в молекуле полярной связи, способствует поляризации ближайших двух-трех а-молекулярных орбиталей (а-связей) и приводит к возникновению частичных зарядов (5) на соседних атомах. Такой электронный эффект заместителя называется индуктивным (I-эффект).
Индуктивный эффект — влияние заместителя на электронную плотность молекулы путем смещения электронов а-связей.
Направление индуктивного эффекта заместителя принято качественно оценивать путем сравнения с атомом водорода, индуктивный эффект которого условно принят за 0. Электроноакцепторные заместители (X), уменьшающие электронную плотность соседних а-связей, проявляют отрицательный индуктивный эффект (-I). Электронодонорные заместители (Y), увеличивающие электронную плотность соседних а-связей, проявляют положительный индуктивный эффект (+I).


Электронодонорными заместителями (+I) являются алкильные группы (—СН3, —С2Н5, —С(СН3)3), анионные группы —О-, —S-, атомы металлов. Они способствуют повышению электронной плотности в цепи и появлению частичных отрицательных зарядов  на соседних атомах.
на соседних атомах.
Графически действие индуктивного эффекта изображают стрелкой, совпадающей с положением черточки связи и направленной острием в сторону более электроотрицательного атома. Индуктивный эффект и-з-за слабой поляризуемости  -связей быстро затухает по углеродной цепи:
-связей быстро затухает по углеродной цепи: 
Электронные эффекты в сопряженных системах. В отличие от насыщенных систем, в которых электронное влияние заместителя (индуктивный эффект) передается по  -связям, в сопряженных системах в передаче электронного влияния участвуют электроны π-молекулярных орбиталей (π -электроны) делокали-зованных связей. При этом заместитель сам является участником сопряженной системы. Такой вид передачи электронного эффекта называется мезомерным (М-эффект) или эффектом сопряжения.
-связям, в сопряженных системах в передаче электронного влияния участвуют электроны π-молекулярных орбиталей (π -электроны) делокали-зованных связей. При этом заместитель сам является участником сопряженной системы. Такой вид передачи электронного эффекта называется мезомерным (М-эффект) или эффектом сопряжения.
Мезомерный эффект - влияние заместителя на электронную плотность молекулы путем смещения π -электронов кратных связей или неподеленных электронных пар гетероатомов.
Смещение подвижных электронов в результате мезомерного эффекта графически обозначается изогнутыми стрелками, начало которых показывает, какие π - или р-электроны смещаются, а их конец указывает связь или атом, к которым они смещаются. В отличие от индуктивного, мезомерный эффект не затухает в пределах всей сопряженной системы, так как я- и р- электроны более подвижны, чем  -электроны.
-электроны.
Заместители, способные к отдаче своей пары электронов в общую сопряженную систему, являются электронодонорными и проявляют положительный мезомерный эффект. +М-Эффект характерен для заместителей, содержащих гетероатомы с неподеленной парой электронов или целым отрицательным зарядом:

Заместители, являющиеся участниками сопряженной системы и содержащие кратную связь с электроотрицательным атомом, оттягивающим на себя делокализованную электронную плотность системы, проявляют отрицательный мезомерный эффект (-М):

Болышинство функциональных групп проявляет и индуктивные, и мезомерные эффекты, действие которых может быть как однонаправленным, так и разнонаправленным. Поэтому при оценке влияния заместителей на распределение электронной плотности в молекуле необходимо учитывать результирующее действие индуктивного и мезомерного эффектов (табл. 15.3).

С помощью табл. 15.3 можно прогнозировать характер изменения электронной плотности на реакционном центре молекулы, вызванного заместителем.
Дата публикования: 2014-10-16; Прочитано: 3670 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
