 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Строение и химические свойства галогенов и их соединений
|
|
Галогены фтор F, хлор С1, бром Вг, иод I являются элементами группы VILA. Электронная конфигурация валентной оболочки атомов галогенов в основном состоянии ns2np5. Наличие пяти электронов на внешней р-орбитали, в том числе одного неспаренного, является причиной высокого сродства галогенов к электрону. Присоединение электрона приводит к образованию галогенид-анионов (F-, С1-, Вг-, I-) с устойчивой 8-электронной оболочкой ближайшего благородного газа. Галогены - ярко выраженные неметаллы.
Самый электроотрицательный элемент фтор имеет в соединениях только одну степень окисления — 1, так как всегда является акцептором электронов. Другие галогены в соединениях могут иметь степень окисления от -1 до +7. Положительные степени окисления галогенов вызваны переходом их валентных электронов на свободные d-орбитали внешнего уровня (разд. 2.1.3) при образовании связей с более электроотрицательными элементами.
Молекулы галогенов двухатомные: F2, С12, Вг2, I2. При стандартных условиях фтор и хлор - газы, бром - летучая жидкость (Tкип = 59 °С), а иод - твердый, но он легко возгоняется (переходит в газообразное состояние, минуя жидкое).
Окислительно-восстановительные свойства. Галогены являются сильными окислителями, вступая во взаимодействие почти со всеми металлами и многими неметаллами:

Особенно высокую химическую активность проявляет фтор, который при нагревании реагирует даже с благородными газами ксеноном, криптоном и радоном:

Химическая активность галогенов уменьшается от фтора к иоду, так как с увеличением радиуса атома способность галогенов присоединять электроны уменьшается:

Более активный галоген всегда вытесняет менее активный из его соединений с металлами. Так, фтор вытесняет все другие галогены из их галогенидов, а бром - только иод из иодидов:

Различная окислительная способность галогенов проявляется и в их действии на организм. Газообразные хлор и фтор из-за очень сильных окислительных свойств являются мощными отравляющими веществами, вызывающими тяжелые поражения легких и слизистых оболочек глаз, носа и гортани. Иод - более мягкий окислитель, проявляющий антисептические свойства, поэтому он широко используется в медицине.
Различия в окислительно-восстановительных свойствах галогенов проявляются и при их взаимодействии с водой. Фтор окисляет воду, при этом восстановителем выступает атом кислорода молекулы волы:
 |
Взаимодействие остальных галогенов с водой сопровождается окислительно-восстановительной дисмутацией их атомов. Так, при реакции хлора с водой один из атомов молекулы хлора, присоединяя электрон от другого атома, восстанавливается, а другой атом хлора, отдавая электрон, окисляется. При этом образуется хлорная вода, содержащая хлористый водород (соляную кислоту) и гипохлористую (хлорноватистую) кислоту:

 |
Реакция является обратимой, а ее равновесие сильно смещено влево. Гипохлористая кислота неустойчива и легко распадается, особенно на свету, с образованием очень сильного окислителя -атомарного кислорода:
Таким образом, хлорная вода содержит в различных концентрациях три окислителя с разной окислительной способностью: молекулярный хлор, гипохлористую кислоту и атомарный кислород, сумму которых часто называют "активный хлор".
Образующийся атомарный кислород обесцвечивает красители и убивает микробы, что объясняет отбеливающее и бактерицидное действие хлорной воды.
Гипохлористая кислота - более сильный окислитель, чем газообразный хлор. Она реагирует с органическими соединениями RH и как окислитель, и как хлорирующий реагент:

Поэтому при хлорировании питьевой воды, содержащей в качестве примесей органические вещества, они могут превратиться в более токсичные хлорорганические соединения RC1. Это обязательно следует учитывать при разработке способов очистки воды и их применении.
 |
При добавлении к хлорной воде щелочи равновесие смещается вправо вследствие нейтрализации гипохлористой и соляной кислот:
 |
Полученный раствор смеси солей, называемый жавелевой водой, используется как отбеливающее и дезинфицирующее средство. Эти свойства обусловлены тем, что гипохлорит калия под действием СО2 + Н20 и в результате гидролиза превращается в неустойчивую гипохлористую кислоту, образующую атомарный кислород. В результате жавелевая вода разрушает красящие вещества и убивает микробы.
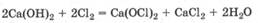 |
При действии газообразного хлора на влажную гашеную известь Са(ОН)2 получают смесь солей СаСl2 и Са(0С1)2, называемую хлорной известью:
 |
Хлорную известь можно рассматривать как смешанную кальциевую соль соляной и гипохлористой кислот CaCl(OCl). Во влажном воздухе хлорная известь, взаимодействуя с водой и углекислым газом, постепенно выделяет гипохлористую кислоту, которая обеспечивает ее отбеливающее, дезинфицирующее и дегазирующие свойства:
При действии на хлорную известь соляной кислоты происходит выделение свободного хлора: 
При нагревании гипохлористая кислота в результате окислительно-восстановительного диспропорционирования разлагается с образованием соляной и хлорноватой кислот:

При пропускании хлора через горячий раствор щелочи, например КОН, образуются хлорид калия и хлорат калия КClO3 (бертолетова соль):

Окислительная способность анионов кислородсодержащих кислот хлора в водных растворах в ряду СlO- - СlO4(-) уменьшается несмотря на возрастание в них степени окисления хлора:

Это объясняется повышением устойчивости анионов в указанном ряду вследствие усиления делокализации их отрицательного заряда. В то же время перхлораты LiC104, КСlO4 в сухом состоянии при высоких температурах являются сильными окислителями и используются для минерализации различных биоматериалов при определении в них содержащихся неорганических компонентов.
Анионы галогенов (кроме F-) способны отдавать электроны, поэтому они являются восстановителями. Восстановительная способность галогенид-анионов по мере возрастания их радиуса увеличивается от хлорид-аниона к иодид-аниону:

Так, иодоводородная кислота окисляется кислородом воздуха уже при обычной температуре:

Соляная кислота не окисляется кислородом, и поэтому хлорид-анион устойчив в условиях организма, что очень важно с позиции физиологии и медицины.
Кислотно-основные свойства. Водородгалогениды HF, НС1, HBr, HI вследствие полярности их молекул хорошо растворяются в воде. При этом происходит гидратация молекул, приводящая к их диссоциации с образованием гидратированных протонов и галогенид-анионов. Сила кислот в ряду HF, НС1, HBr, HI возрастает вследствие увеличения радиуса и поляризуемости анионов от F- к I-.
Соляная кислота как компонент желудочного сока играет важную роль в процессе пищеварения. В основном за счет соляной кислоты, массовая доля которой в желудочном соке составляет 0,3 %, его рН поддерживается в интервале от 1 до 3. Соляная кислота способствует переходу фермента пепсина в активную форму, что обеспечивает переваривание белков за счет гидролитического расщепления пептидных связей с образованием различных аминокислот:

Определение содержания соляной кислоты и других кислот в желудочном соке было рассмотрено в разд. 8.3.3.
В ряду кислородсодержащих кислот хлора по мере увеличения его степени окисления сила кислот увеличивается.

Это связано с увеличением полярности связи О—Н из-за смещения ее электронной плотности к атому хлора, а также из-за повышения устойчивости анионов.
 |
Комплексообразующие свойства. Анионы галогенов склонны к комплексообразованию в качестве лигандов. Устойчивость галогенидных комплексов обычно уменьшается в ряду F- > Сl- > Вr- > > I-. Именно процессом комплексообразования объясняется токсическое действие фторид-анионов, которые, образуя фторидные комплексы с катионами металлов, входящих в активные центры ферментов, подавляют их активность.
 |
Интересные комплексообразующие свойства проявляет молекула иода. Так, растворимость молекулярного иода в воде резко возрастает в присутствии иодида калия, что связано с образованием комплексного аниона
Невысокая устойчивость этого комплексного иона обеспечивает наличие молекулярного иода в растворе. Поэтому в медицине используется в качестве бактерицидного средства водный раствор иода с добавлением KI. Кроме того, молекулярный иод образует комплексы включения с крахмалом (разд. 22.3) и поливиниловым спиртом (синий иод). В этих комплексах молекулы иода или их ассоциаты с иодид-анионами заполняют каналы, образованные спиралевидной структурой соответствующих полигидроксиполимеров. Комплексы включения не очень устойчивы и способны постепенно отдавать молекулярный иод. Поэтому такой препарат, как синий иод, является эффективным, но мягким бактерицидным средством пролонгированного действия.
Биологическая роль и применение галогенов и их соединений в медицине. Галогены в виде различных соединений входят в состав живых тканей. В организме все галогены имеют степень окисления — 1. При этом хлор и бром существуют в виде гидратированных анионов Сl- и Вr-, а фтор и иод входят в состав нерастворимых в воде биосубстратов:.
Соединения фтора являются компонентами костной ткани, ногтей и зубов. Биологическое действие фтора прежде всего связано с проблемой болезней зубов. Фторид-анион, замещая в гидроксиапатите гидроксид-ион, образует слой защитной эмали из твердого фторапатита:

Фторирование питьевой воды до концентрации фторид-иона 1 мг/л и добавление фторида натрия в зубную пасту значительно снижают кариес зубов у населения. В то же время при концентрации фторид-аниона в питьевой воде выше 1,2 мг/л повышается хрупкость костей, зубной эмали и появляется общее истощение организма, называемое флуорозом.
Хлорид-анионы обеспечивают ионные потоки через клеточные мембраны, участвуют в поддержании осмотического гомеостаза, создают благоприятную среду для действия и активации протолитических ферментов желудочного сока.
Бромид-анионы в организме человека локализуются преимущественно в гипофизе и других железах внутренней секреции. Установлено наличие динамической связи между содержанием в организме бромид- и хлорид-анионов. Так, повышенное содержание в крови бромид-анионов способствует быстрому выделению почками хлорид-анионов. Бромиды локализуются в основном в межклеточной жидкости. Они усиливают тормозные процессы в нейронах коры головного мозга, в связи с чем бромиды калия, натрия и бромкамфора применяются в фармакологии.
Иод и его соединения влияют на синтез белков, жиров и гормонов. Больше половины количества иода находится в щитовидной железе в связанном состоянии в виде тиреоидных гормонов. При недостаточном поступлении иода в организм развивается эндемический зоб. С целью профилактики этого заболевания к поваренной соли добавляют NaI или KI (1-2 г на 1 кг NaCl). Таким образом, все галогены необходимы для нормального функционирования живых организмов.
Глава 13
Дата публикования: 2014-10-16; Прочитано: 7892 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
