 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Кислород и его соединения
|
|
Кислород - самый распространенный элемент биосферы (более 50 % по массе). Без кислорода невозможны многочисленные чрезвычайно важные жизненные процессы, прежде всего дыхание и окисление биосубстратов. Только немногие живые организмы, называемые анаэробными, могут обходиться без кислорода.
Кислород в периодической системе находится во втором периоде в группе VIA. Электронная конфигурация его атома Наличие двух неспаренных электронов обеспечивает образование двух связей. Отсутствие вакантных атомных орбиталей во внешнем слое не позволяет кислороду повысить валентность за счет распаривания электронов, как это имеет место у его ближайшего соседа по группе атома серы. Наличие двух неподеленных пар электронов дает возможность атому кислорода выступать в роли донора одной из них при образовании донорно-акцепторной связи. В случае самоассоциации молекул воды за счет водородных связей атом кислорода выступает донором обеих неподеленных пар электронов (разд. 6.1).
Степень окисления кислорода в соединениях обычно равна -2. Однако существуют соединения, в которых степень окисления кислорода -1 (Н202, пероксиды) и даже +2 (дифторид кислорода OF2). Малый размер атома (75 пм), высокое значение энергии ионизации (1313 кДж/моль), большое сродство к электрону (142 кДж/моль) сообщают кислороду свойство окислителя. Высокая электроотрицательность (ОЭО = 3,5) позволяет кислороду оттягивать на себя общие электроны связи, поэтому его связи с другими элементами полярны.
Кислород существует в двух аллотропных модификациях: дикислород 02 (кислород) и трикислород 03 (озон), которые при стандартных условиях являются газами. В атмосфере практически весь кислород содержится в виде 02. Озон в основном находится на высоте 22 км, но и там его объемная доля составляет 10-6 %. Свойства озона будут рассмотрены в разд. 14.1.2.
Поскольку энергия связи в молекуле кислорода 02 составляет 494 кДж/моль, то она термически очень устойчива и диссоциирует лишь начиная с 1500 °С. Что касается высокой химической активности кислорода, определяющей его ведущую роль в процессах метаболизма, то она объясняется тем, что молекула кислополя имеет структуру бирадикала ("триплетный кислород"  ). Этим же объясняется и парамагнитность кислорода, вследствие которой его струя отклоняется в магнитном поле.
). Этим же объясняется и парамагнитность кислорода, вследствие которой его струя отклоняется в магнитном поле.
Окислительно-восстановительные свойства. Главная химическая функция кислорода в организме - окисление веществ, которое всегда сопровождается выделением энергии. Биологическое окисление подразделяют на свободное окисление, при котором выделяющаяся энергия переходит в тепловую и рассеивается, и сопряженное окисление, когда выделяющаяся энергия используется для протекания эндэргонических реакций. Например, для протекания реакций восстановления биосубстратов с помощью восстановленной формы кофермента НАДФ(Н) соответствующих дегидрогеназ (разд. 9.3.5) или окислительного фосфорилирования (разд. 9.3.6 и рис. 9.2).
Для клетки очень важно, чтобы происходила полная утилизация кислорода: 
Если процесс восстановления кислорода нарушается, то образуются различные активные формы кислорода: супероксидный анион-радикал 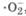 , гидропероксидный радикал
, гидропероксидный радикал  , пероксид водорода Н202, гидроксидный радикал
, пероксид водорода Н202, гидроксидный радикал  и синглетный ки-слород
и синглетный ки-слород  'способствующие свободнорадикальному окислению биосубстратов (разд. 9.3.9).
'способствующие свободнорадикальному окислению биосубстратов (разд. 9.3.9).
Источником активных форм кислорода может также выступать оксигемоглобин ННb02, в тех случаях, когда происходит окисление его иона-комплексообразователя Fe2+ сильными окислителями или активация его лиганда - молекулы кислорода -при взаимодействии с сильными восстановителями. Нарушение окислительно-восстановительных превращений ионов-комплексообразователей в различных цитохромах также может способствовать образованию активных форм кислорода. Это же происходит при радиационном воздействии на организм из-за активации и распада молекул воды с образованием различных радикалов.
За счет кислорода с помощью соответствующих ферментов в организме протекает оксигеназное и диоксигеназное окисление биосубстратов (разд. 9.3.8). Необходимо отметить, что регулируемое окисление кислородом биосубстратов всегда происходит при участии ферментов. При этом прямого контакта биосубстрата с кислородом нет, а есть контакт между ними только через ансамбли ферментов, что и позволяет регулировать процесс окисления. При прямом контакте субстрата с какой-либо активной формой кислорода окислительно-восстановительный процесс протекает по радикальному механизму, и его скорость зависит от концентрации свободных радикалов в клетке.
 |
Защита от вредного действия активных форм кислорода осуществляется с помощью антиоксидантной системы (разд. 9.3.9), в которую входят ферменты супероксиддисмутаза (СОД) и каталаза. Под действием СОД супероксидный радикал превращается в кислород и пероксид водорода, который разлагается под действием каталазы, превращаясь в кислород и воду:
Образовавшийся кислород опять принимает участие в биологическом окислении. Утилизации пероксида водорода в клетке помогает фермент пероксидаза, который катализирует перекисное окисление органических веществ. Наличие пероксидазы в лейкоцитах способствует уничтожению бактерий и веществ, поглощенных лейкоцитарными клетками.
Пероксид водорода Н202 широко используется в медицинской практике в основном как наружное бактерицидное средство. Действие Н202 основано на его окислительной способности и безвредности образующихся продуктов 02 и Н20. Выделяющийся кислород оказывает противомикробное, дезодорирующее и депигментирующее действие. В то же время образующаяся пена способствует очищению ран, удаляя из них частицы тканевого распада. Фармакопейный препарат содержит 3 % Н202, для обесцвечивания волос используется б % раствор, а 30 % раствор (пергидроль) применяют для удаления юношеских бородавок и лечения красного плоского лишая.
Чистый пероксид водорода термодинамически нестабилен и легко разлагается на воду и кислород, а на свету этот процесс протекает со взрывом:

Реакция разложения Н202 сопровождается окислительно-восстановительной дисмутацией атомов кислорода со степенью окисления -1. Поскольку концентрация водных растворов Н202 может постоянно снижаться вследствие его разложения, их хранят в темной или непрозрачной посуде. Удобной формой для хранения Н202 является гидроперит - таблетки, содержащие комплекс мочевины с пероксидом водорода CO(NH2)2 • Н202. Для приготовления раствора Н202 таблетку гидроперита растворяют в воде.
При действии восстановителей пероксид водорода выступает в роли окислителя:

Удаление ионов ОН" из зоны реакции способствует усилению окислительных свойств Н202.

 |
Восстановительные свойства пероксид водорода проявляет только по отношению к сильным окислителям, окисляясь до свободного кислорода:
Эта реакция используется дляопределения концентрации пероксида водорода в растворах.
Растворы Н2О2 широко используются для отбеливания тканей и шерсти, для обеззараживания воды. В санитарно-гигиенической практике Н2О2 применяется как дезинфицирующее средство, которое "не загрязняет" очищаемые водные системы продуктами восстановления, так как при этом получается только вода.
В водном растворе пероксид водорода - слабая кислота (Ki = 1,5*10-12), соли которой полностью гидролизуются.
Кислотно-основные свойства. Кислородсодержащие соединения с общей формулой R—О—Н в зависимости от природы R и соотношения полярностей связей R—О и О—Н способны в водных растворах диссоциировать как основания: 
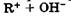 или как кислоты:
или как кислоты: 
Если R - электронодонорный заместитель, например атом активного металла (Na—О—Н, НО—Ва—О—Н), то мы имеем дело с гидроксидом, для которого характерны основные свойства, так как связь R—О более полярна, чем О—Н.
Если R - электроноакцепторный заместитель, состоящий из атомов типичных неметаллов (Н—О—СlO3, Н—О—N02, Н—О—S02—ОН), или соответствующий органический радикал (СН3СО—ОН, С6Н5-0—Н), то в этом случае полярность связи R—О уменьшается, а связи О—Н сильно возрастает, и для таких соединений характерны кислотные свойства.
Если R не проявляет четко выраженной тенденции к взаимодействию с общей электронной парой связи R—О, то возможны два варианта. В первом диссоциации подвергаются обе связи: в зависимости от свойств партнера или R—О, или О—Н. В этом случае имеем дело с амфолитом (разд. 8.1). Во втором обе эти связи устойчивы к диссоциации в водной среде, например в случае одноатомных алифатических спиртов (разд. 17.3). Таким образом, кислотно-основные свойства кислородсодержащих соединений типа ROH определяются свойствами заместителя при группе ОН и партнера, с которым они взаимодействуют.
Комплексообразующие свойства. Молекула кислорода, хотя и содержит неподеленные электронные пары, является малоактивным лигандом. Кислород плохо растворяется в воде. При 20 °С в 100 объемах воды растворяется лишь 3,1 объема кислорода, поэтому один литр плазмы крови переносит лишь 5 мл кислорода в растворенном виде. Функцию транспорта кислорода у высших животных выполняет находящийся в эритроцитах гемоглобин, который, соединяясь в легких с кислородом, образует легко диссоциирующий комплекс оксигемоглобин (разд. 10.4). Благодаря оксигемоглобину один литр крови переносит 250 мл кислорода в капилляры различных органов. Здесь оксигемоглобин отдает кислород, который диффундирует через стенки капилляров в ткани. Меньшая часть поступившего кислорода соединяется за счет донорно-акцепторной связи с миоглобином для накопления кислорода в тканях и поддержания необходимого парциального давления, а основная часть вступает в процессы метаболизма, превращаясь в конце концов в оксид углерода(4) и воду, которые с помощью венозной крови выводятся из организма через легкие и почки.
Кислородсодержащие соединения из-за низкой подвижности неподеленных электронных пар атома кислорода также являются малоактивными лигандами. Однако, если кислородсодержащая группа в соединении образует анион, то подвижность электронных пар в системе, несущей отрицательный заряд, резко возрастает. Это способствует образованию комплексных соединений. Так, многоатомные спирты или многоосновные органические кислоты дают в щелочной среде устойчивые хелатные комплексы с катионами d-металлов:

В заключение следует подчеркнуть, что главная химическая функция кислорода в живой природе - окислительная.
Круговорот кислорода в природе. В атмосфере нашей планеты в настоящее время содержится 1,2 • 1015 т кислорода. В результате фотосинтеза растения ежегодно выделяют в атмосферу 2,5 • 1011 т кислорода. Почти такое же количество в течение года расходуется в процессах дыхания и гниения растительных и животных остатков. Основными конечными продуктами этих окислительных процессов являются СО2 и Н2О. Регенерация кислорода из них совершается в растениях за счет фотосинтеза (разд. 9.3.7). Таким образом, в результате круговорота кислорода, в основе которого лежат окислительно-восстановительные процессы и который тесно связан с круговоротом углерода (разд. 12.2.2), в атмосфере поддерживается постоянное содержание кислорода.
Дата публикования: 2014-10-16; Прочитано: 3303 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
