 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Марганец
|
|
В организме человека содержится около 12 мг марганца, причем 43 % этого количества находится в костях, остальное -в мягких тканях.
Марганец - элемент 4 периода VIIБ группы периодической системы. Электронная конфигурация атома марганца ls22s22p63s23p63d54s2, орбитальный радиус 128 пм. В соединениях он проявляет различные степени окисления: +2, +3, +4, +6, +7. Как у всех d-элементов, соединения марганца с низшей степенью окисления +2 проявляют основные и восстановительные свойства.
В нейтральных или кислых водных растворах двухвалентный марганец образует окрашенный в бледно-розовый цвет аквакомплекс [Мn(Н20)6]2+, который довольно прочно удерживает молекулы воды (т = 10(-6) с) и устойчив к окислению в данных условиях. В щелочной среде образуется малорастворимый гидроксид Мп(ОН)2, неустойчивый по отношению к кислороду, растворенному в воде. Соединения марганца с высшими степенями окисления +6,+7 проявляют кислотные и окислительные свойства. В водных растворах существуют в виде кислородсодержащих анионов: манганат МпО4(2-) и перманганат MnO4(-). Соединения марганца с промежуточными степенями окисления проявляют амфотерность и окислительновосстановительную двойственность. Эти закономерности хорошо прослеживаются в свойствах оксидов и гидроксидов марганца:
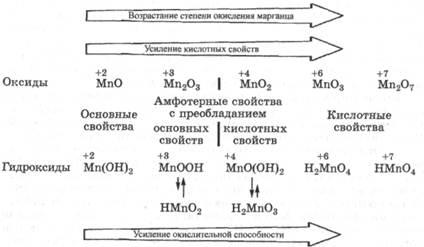 |
Изменение кислотно-основных свойств соединений марганца в зависимости от его степени окисления можно иллюстрировать следующими реакциями:
 |
Окислительно-восстановительные свойства соединений марганца(2) сильно зависят от кислотности среды и окислительно-восстановительных свойств партнера:

Последняя реакция используется в санитарно-гигиенической практике для определения концентрации растворенного кислорода в анализируемой воде (разд. 14.3).
Соединения Mn(IV) могут быть и окислителями и восстановителями, в зависимости от свойств второго реагента:

 |
Соли манганаты, содержащие анион
 , устойчивы только в сильнощелочной среде, а в остальных средах неустойчивы. Так, в нейтральной среде протекает реакция окислительно-восстановительного диспропорционирования:
, устойчивы только в сильнощелочной среде, а в остальных средах неустойчивы. Так, в нейтральной среде протекает реакция окислительно-восстановительного диспропорционирования:
 |
Для организма перманганаты ядовиты при попадании внутрь из-за их сильных окислительных свойств. Для обезвреживания острых отравлений перманганатом используют 3 % раствор пероксида водорода в уксуснокислой среде:

Раствор перманганата калия является прижигающим и бактерицидным препаратом для обработки поверхности кожи и слизистых оболочек. Сильные окислительные свойства перманганата в кислой среде лежат в основе метода перманганатометрии, широко используемого в санитарно-клиническом анализе.
В биологических системах марганец присутствует в виде ионов Мп2+ или его комплексов с белками, нуклеиновыми кислотами и аминокислотами. Хотя эти комплексы из-за большого радиуса катиона Мп2+ и его жесткости обычно мало устойчивы, они способствуют активации большого числа ферментов разных классов: трансфераз, гидролаз, изомераз. Ионы Мп2+ стабилизируют конформацию нуклеиновых кислот, участвуют в процессах репликации ДНК, синтезе РНК и белка. Таким образом, биогенная функция ионов марганца имеет широкий спектр: оказывает влияние на кроветворение, образование костей, минеральный обмен, рост, размножение и некоторые другие функции.
Еще одна особенность иона Мп2+ - универсализм, так как он может выполнять каталитическую функцию подобно Сu2+, Fe2+, Zn2+, но в то же время действовать подобно Mg2+ и Са2+. В отличие от Мn2+, катион Мn3+ очень прочно связывается с белками, причем преимущественно с кислородными донорными группами, и поэтому Мn3+ совместно с Fe3+ входит в состав трансфе рина, супероксиддисмутазы и кислотной фосфатазы, т. е. в состав типичных металлопротеинов.
Дата публикования: 2014-10-16; Прочитано: 4150 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
