 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Углерод и его соединения
|
|
Углерод в периодической системе элементов располагается во втором периоде в группе IVA. Электронная конфигурация атома углерода ls22s22p2. При его возбуждении легко достигается электронное состояние, при котором на четырех внешних атомных орбиталях находятся четыре неспаренных электрона:

Это объясняет, почему углерод в соединениях обычно четырехвалентен. Равенство в атоме углерода числа валентных электронов числу валентных орбиталей, а также уникальное соотношение заряда ядра и радиуса атома сообщают ему способность одинаково легко присоединять и отдавать электроны в зависимости от свойств партнера (разд. 9.3.1). Вследствие этого для углерода характерны различные степени окисления от —4 до +4 и легкость гибридизации его атомных орбиталей по типу sp3, sp2 и sp1 при образовании химических связей (разд. 2.1.3):

Все это дает углероду возможность образовывать ординарные, двойные и тройные связи не только между собой, но и с атомами других элементов-органогенов. Молекулы, образующиеся  при этом, могут иметь линейное, разветвленное и циклическое строение.
при этом, могут иметь линейное, разветвленное и циклическое строение.
Вследствие подвижности общих электронов  -МО, образованных с участием атомов углерода, происходит их смещение в сторону атома более электроотрицательного элемента (индуктивный эффект), что приводит к полярности не только этой связи, но и молекулы в целом. Однако углерод, благодаря среднему значению электроотрицательности (0Э0 = 2,5), образует с атомами других элементов-органогенов слабополярные связи (табл. 12.1). При наличии в молекулах систем сопряженных связей (разд. 2.1.3) происходит делокализация подвижных электронов
-МО, образованных с участием атомов углерода, происходит их смещение в сторону атома более электроотрицательного элемента (индуктивный эффект), что приводит к полярности не только этой связи, но и молекулы в целом. Однако углерод, благодаря среднему значению электроотрицательности (0Э0 = 2,5), образует с атомами других элементов-органогенов слабополярные связи (табл. 12.1). При наличии в молекулах систем сопряженных связей (разд. 2.1.3) происходит делокализация подвижных электронов 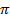 -МО и неподеленных электронных пар с выравниванием электронной плотности и длин связей в этих системах.
-МО и неподеленных электронных пар с выравниванием электронной плотности и длин связей в этих системах.

С позиции реакционной способности соединений большую роль играет поляризуемость связей (разд. 2.1.3). Чем больше поляризуемость связи, тем выше ее реакционная способность. Зависимость поляризуемости углеродсодержащих связей от их природы отражает следующий ряд:

Все рассмотренные данные о свойствах углеродсодержащих связей свидетельствуют о том, что углерод в соединениях образует, с одной стороны, достаточно прочные ковалентные связи между собой и с другими органогенами, а с другой стороны - общие электронные пары этих связей достаточно лабильны. В результате этого может происходить как увеличение реакционной способности этих связей, так и стабилизация. Именно эти особенности углеродсодержащих соединений и делают углерод органогеном номер один.
Кислотно-основные свойства соединений углерода. Оксид углерода(4) является кислотным оксидом, а соответствующий ему гидроксид - угольная кислота Н2СО3 - слабой кислотой. Молекула оксида углерода(4) неполярна, и поэтому он плохо растворяется в воде (0,03 моль/л при 298 К). При этом вначале в ратворе образуется гидрат СО2 Н2О, в котором СО2 находится в полости ассоциата из молекул воды, а затем этот гидрат медленно и обратимо превращается в Н2СО3. Большая часть растворенного в воде оксида углерода(4) находится в виде гидрата.
В организме в эритроцитах крови под действием фермента каррбоангидразы равновесие между гидратом CO2 • Н2О и Н2СО3 устанавливается очень быстро. Это позволяет пренебречь наличием СО2 в виде гидрата в эритроците, но не в плазме крови, где нет карбоангидразы. Образующаяся Н2СО3 диссоциирует в физиологических условиях до гидрокарбонат-аниона, а в более щелочной среде - до карбонат-аниона:

Угольная кислота существует только в растворе. Она образует два ряда солей - гидрокарбонаты (NаНСОз, Са(НС03)2) и карбонаты (Nа2СОз, СаСОз). В воде гидрокарбонаты растворяются лучше, чем карбонаты. В водных растворах соли угольной кислоты, особенно карбонаты, легко гидролизуются по аниону, создавая щелочную среду:

Такие вещества, как питьевая сода NaHC03; мел СаСОз, белая магнезия 4MgC03 * Mg(OH)2 * Н2О, гидролизующиеся с образонанием щелочной среды, применяются в качестве антацидных (нейтрализующих кислоты) средств для снижения повышенной кислотности желудочного сока:

Совокупность угольной кислоты и гидрокарбонат-иона (Н2СО3, НСО3(-)) образует гидрокарбонатную буферную систему (разд. 8.5) -славную буферную систему плазмы крови, которая обеспечивает постоянство рН крови на уровне рН = 7,40 ± 0,05.
 |
Наличие в природных водах гидрокарбонатов кальция и магния обуславливает их временную жесткость. При кипячении такой воды ее жесткость устраняется. Это происходит из-за гидролиза аниона HCO3(-)), термического разложения угольной кислоты и осаждения катионов кальция и магния в виде нерастворимых соединений СаС03 и Mg(OH)2:
Образование Mg(OH)2 вызвано полным гидролизом по катиону магния, протекающему в этих условиях из-за меньшей растворимости Mg(0H)2 по сравнению с MgC03.
В медико-биологической практике кроме угольной кислоты приходится сталкиваться с другими углеродсодержащими кислотами. Это прежде всего большое множество различных органических кислот, а также синильная кислота HCN. С позиции кислотных свойств сила этих кислот различна:
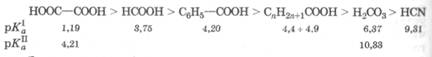
Эти различия обусловлены взаимным влиянием атомов в молекуле, природой диссоциирующей связи и устойчивостью аниона, т. е. его способностью к делокализации заряда.
Синильная кислота, или циановодород, HCN - бесцветная, легколетучая жидкость (Ткип = 26 °С) с запахом горького миндаля, смешивающаяся с водой в любых соотношениях. В водных растворах ведет себя как очень слабая кислота, соли которой называются цианидами. Цианиды щелочных и щелочноземельных металлов растворимы в воде, при этом они гидролизуются по аниону, из-за чего их водные растворы пахнут синильной кислотой (запах горького миндаля) и имеют рН >12:
 |
При длительном воздействии СО2, содержащегося в воздухе, цианиды разлагаются с выделением синильной кислоты:
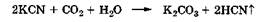
В результате этой реакции цианид калия (цианистый калий) и его растворы при длительном хранении теряют свою токсичность. Цианид-анион - один из самых сильных неорганических ядов, поскольку он является активным лигандом и легко образует устойчивые комплексные соединения с ферментами, содержащими в качестве ионовкомплексообразователей Fe3+ и Сu2(+) (разд. 10.4).
Окислительно-восстановительные свойства. Поскольку углерод в соединениях может проявлять любые степени окисления от -4 до +4, то в ходе реакции свободный углерод может и отдавать и присоединять электроны, выступая соответственно восстановителем или окислителем в зависимости от свойств второго реагента:

 |
При взаимодействии сильных окислителей с органическими веществами может протекать неполное или полное окисление атомов углерода этих соединений.
В условиях анаэробного окисления при недостатке или в отсутствие кислорода атомы углерода органического соединения в зависимости от содержания кислородных атомов в этих соединениях и внешних условий могут превратиться в С02, СО, С и даже СН4, а остальные органогены превращаются в Н2О, NH3 и H2S.
В организме полное окисление органических соединений кислородом в присутствии ферментов оксидаз (аэробное окисление) описывается уравнением:

Из приведенных уравнений реакций окисления видно, что в органических соединениях степень окисления изменяют только атомы углерода, а атомы остальных органогенов при этом сохраняют свою степень окисления.
При реакциях гидрирования, т. е. присоединения водорода (восстановителя) по кратной связи, образующие ее атомы углерода понижают свою степень окисления (выступают окислителями):

Органические реакции замещения с возникновением новой межуглеродной связи, например в реакции Вюрца, также являются окислительно-восстановительными реакциями, в которых атомы углерода выступают окислителями, а атомы металла -восстановителями:

Подобное наблюдается в реакциях образования металлорганических соединений:

 |
В то же время в реакциях алкилирования с возникновением новой межуглеродной связи роль окислителя и восстановителя играют атомы углерода субстрата и реагента соответственно:
В результате реакций присоединения полярного реагента к субстрату по кратной межуглеродной связи один из атомов углерода понижает степень окисления, проявляя свойства окислителя, а другой - повышает степень окисления, выступая восстановителем:

В этих случаях имеет место реакция внутримолекулярного окисления-восстановления атомов углерода субстрата, т. е. процесс дисмутации, под действием реагента, не проявляющего окислительно-восстановительных свойств.
Типичными реакциями внутримолекулярной дисмутации органических соединений за счет их атомов углерода являются реакции декарбоксилирования аминокислот или кетокислот, а также реакции перегруппировки и изомеризации органических соединений, которые были рассмотрены в разд. 9.3. Приведенные примеры органических реакций, а также реакции из разд. 9.3 убедительно свидетельствуют, что атомы углерода в органических соединениях могут быть и окислителями, и восстановителями.
Атом углерода в соединении - окислитель, если в результате реакции увеличивается число его связей с атомами менее электроотрицательных элементов (водород, металлы), потому что, притягивая к себе общие электроны этих связей, рассматриваемый атом углерода понижает свою степень окисления.

Атом углерода в соединении - восстановитель, если в результате реакции увеличивается число его связей с атомами более электроотрицательных элементов (С, О, N, S), потому что, отталкивая от себя общие электроны этих связей, рассматриваемый атом углерода повышает свою степень окисления.

Таким образом, многие реакции в органической химии вследствие окислительно-восстановительной двойственности атомов углерода являются окислительно-восстановительными. Однако, в отличие от подобных реакций неорганической химии, перераспределение электронов между окислителем и восстановителем в органических соединениях может сопровождаться лишь смещением общей электронной пары химической связи к атому, выполняющему роль окислителя. При этом данная связь может сохраняться, но в случаях сильной ее поляризации она может и разорваться.
Комплексообразующие свойства соединений углерода. У атома углерода в соединениях нет неподеленных электронных пар, и поэтому лигандами могут выступать только соединения углерода, содержащие кратные связи с его участием. Особенно активны в процессах комплексообразования 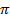 -электроны тройной полярной связи оксида углерода(2) и аниона синильной кислоты.
-электроны тройной полярной связи оксида углерода(2) и аниона синильной кислоты.
В молекуле оксида углерода(2) атомы углерода и кислорода образуют одну  и одну
и одну 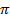 -связь за счет взаимного перекрывания их двух 2р-атомных орбиталей по обменному механизму. Третья связь, т. е. еще одна
-связь за счет взаимного перекрывания их двух 2р-атомных орбиталей по обменному механизму. Третья связь, т. е. еще одна 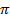 -связь, образуется по донорно-акцепторному механизму. Акцептором является свободная 2р-атомная ор-биталь атома углерода, а донором - атом кислорода, предоставляющий неподеленную пару электронов с 2p-орбитали:
-связь, образуется по донорно-акцепторному механизму. Акцептором является свободная 2р-атомная ор-биталь атома углерода, а донором - атом кислорода, предоставляющий неподеленную пару электронов с 2p-орбитали:

Повышенная кратность связи  обеспечивает этой молекуле высокую стабильность и инертность при нормальных условиях с позиции кислотно-основных (СО - несолеобразующий оксид) и окислительно-восстановительных свойств (СО — восстановитель при Т > 1000 К). В то же время она делает его активным лигандом в реакциях комплексообразования с атомами и катионами d-металлов, прежде всего с железом, с которым он образует пентакарбонил железа - летучую ядовитую жидкость:
обеспечивает этой молекуле высокую стабильность и инертность при нормальных условиях с позиции кислотно-основных (СО - несолеобразующий оксид) и окислительно-восстановительных свойств (СО — восстановитель при Т > 1000 К). В то же время она делает его активным лигандом в реакциях комплексообразования с атомами и катионами d-металлов, прежде всего с железом, с которым он образует пентакарбонил железа - летучую ядовитую жидкость:

 |
Способность к образованию комплексных соединений с катионами d-металлов является причиной ядовитости оксида углерода(Н) для живых систем (разд. 10.4) вследствие протекания обратимых реакций с гемоглобином и оксигемоглобином, содержащими катион Fe2+, с образованием карбоксигемоглобина:
Эти равновесия смещены в сторону образования карбоксигемоглобина ННbСО, устойчивость которого в 210 раз больше, чем оксигемоглобина ННbО2. Это приводит к накоплению карбоксигемоглобина в крови и, следовательно, к снижению ее способности переносить кислород.
В анионе синильной кислоты CN- также содержатся легко поляризуемые 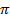 - электроны, из-за чего он эффективно образует комплексы с d-металлами, включая металлы жизни, входящие в состав ферментов. Поэтому цианиды являются высокотоксичными соединениями (разд. 10.4).
- электроны, из-за чего он эффективно образует комплексы с d-металлами, включая металлы жизни, входящие в состав ферментов. Поэтому цианиды являются высокотоксичными соединениями (разд. 10.4).
Круговорот углерода в природе. В основе круговорота углерода в природе в основном лежат реакции окисления и восстановления углерода (рис. 12.3).
Из атмосферы и гидросферы растения ассимилируют (1) оксид углерода(4). Часть растительной массы потребляется (2) человеком и животными. Дыхание животных и гниение их останков (3), а также дыхание растений, гниение отмерших растений и горение древесины (4) возвращают атмосфере и гидросфере CO2. Процесс минерализации останков растений (5) и животных (6) с образованием торфа, ископаемых углей, нефти, газа приводит к переходу углерода в природные ископаемые. В том же направлении действуют кислотно-основные реакции (7), протекающие между СО2 и различными горными породами с образованием карбонатов (средних, кислых и основных):
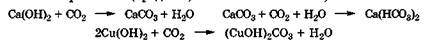
Эта неорганическая часть круговорота приводит к потерям СО2 в атмосфере и гидросфере. Деятельность человека по сжиганию и переработке угля, нефти, газа (8), дров (4), наоборот, с избытком обогащает окружающую среду оксидом углерода(4). Долгое время существовала уверенность, что благодаря фотосинтезу концентрация СО2 в атмосфере сохраняется постоянной. Однако в настоящее время увеличение содержания СО2 в атмосфере за счет деятельности человека не компенсируется его естественной убылью. Общее поступление СО2 в атмосферу растет в геометрической прогрессии на 4-5 % в год. Согласно расчетам в 2000 году содержание СО2 в атмосфере достигнет приблизительно 0,04 % вместо 0,03 % (1990 г.).
После рассмотрения свойств и особенностей углеродсодержащих соединений следует еще раз подчеркнуть ведущую роль углерода

Рис. 12.3. Круговорот углерода в природе
органогена № 1: во-первых, атомы углерода формируют скелет молекул органических соединений; во-вторых, атомы углерода играют ключевую роль в окислительно-восстановительных процессах, поскольку среди атомов всех органогенов именно для углерода наиболее характерна окислительно-восстановительная двойственность. Подробнее о свойствах органических соединений - см. модуль IV "Основы биоорганической химии".
Общая характеристика и биологическая роль р-элементов группы IVA. Электронными аналогами углерода являются элементы IVA группы: кремний Si, германий Ge, олово Sn и свинец Рb (см. табл. 1.2). Радиусы атомов этих элементов закономерно возрастают с увеличением порядкового номера, а их энергия ионизации и электроотрицательность при этом закономерно снижаются (разд. 1.3). Поэтому первые два элемента группы: углерод и кремний - типичные неметаллы, а германий, олово, свинец -металлы, так как для них наиболее характерна отдача электронов. В ряду Ge - Sn - Рb металлические свойства усиливаются.
С позиции окислительно-восстановительных свойств элементы С, Si, Ge, Sn и Рb в обычных условиях достаточно устойчивы по отношению к воздуху и воде (металлы Sn и Рb - за счет образования оксидной пленки на поверхности). В то же время соединения свинца(4) - сильные окислители:

Комплексообразующие свойства наиболее характерны для свинца, так как его катионы Рb2+ являются сильными комплексообразователями по сравнению с катионами остальных р-элементов IVA группы. Катионы свинца образуют прочные комплексы с биолигандами.
Элементы группы IVA резко различаются как по содержанию в организме, так и по биологической роли. Углерод играет основополагающую роль в жизнедеятельности организма, где его содержание составляет около 20 %. Содержание в организме остальных элементов IVA группы находится в пределах 10-6-10-3 %. В то же время, если кремний и германий, несомненно, играют важную роль в жизнедеятельности организма, то олово и особенно свинец - токсичны. Таким образом, с ростом атомной массы элементов IVA группы токсичность их соединений возрастает.
Пыль, состоящая из частиц угля или диоксида кремния SiO2, при систематическом воздействии на легкие вызывает заболевания - пневмокониозы. В случае угольной пыли это антракоз -профессиональное заболевание шахтеров. При вдыхании пыли, содержащей Si02, возникает силикоз. Механизм развития пневмокониозов еще не установлен. Предполагается, что при длительном контакте силикатных песчинок с биологическими жидкостями образуется поликремниевая кислота Si02 •yH2O в гелеобразном состоянии, отложение которой в клетках ведет к их гибели.
Токсическое действие свинца известно человечеству очень давно. Использование свинца для изготовления посуды и водопроводных труб приводило к массовому отравлению людей. В настоящее время свинец продолжает быть одним из основных загрязнителей окружающей среды, так как выброс соединений свинца в атмосферу составляет свыше 400 000 т ежегодно. Свинец накапливается в основном в скелете в форме малорастворимого фосфата РЬз(Р04)2, а при деминерализации костей оказывает регулярное токсическое действие на организм. Поэтому свинец относится к кумулятивным ядам. Токсичность соединений свинца связана прежде всего с его комплексообразующими свойствами и большим сродством к биолигандам, особенно содержащим сульфгидрильные группы (—SH):

Образование комплексных соединений ионов свинца с белками, фосфолипидами и нуклеотидами приводит к их денатурации. Часто ионы свинца ингибируют металлоферменты ЕМ2+, вытесняя из них катионы металлов жизни:

Свинец и его соединения относятся к ядам, действующим преимущественно на нервную систему, кровеносные сосуды и кровь. При этом соединения свинца влияют на синтез белка, энергетический баланс клеток и их генетический аппарат.
В медицине применяются как вяжущие наружные антисептические средства: свинец ацетат Рb(СНзСОО)2 • ЗН2О (свинцовые примочки) и свинец(2) оксид РbО (свинцовый пластырь). Ионы свинца этих соединений вступают в реакции с белками (альбуминами) цитоплазмы микробных клеток и тканей, образуя гелеобразные альбуминаты. Образование гелей убивает микробы и, кроме того, затрудняет проникновение их внутрь клеток тканей, что снижает местную воспалительную реакцию.
Дата публикования: 2014-10-16; Прочитано: 7891 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
