 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Фосфор и его соединения
|
|
В периодической системе фосфор, как и азот, находится в группе VA, но в III периоде. Его электронная конфигурация ls22s22p63s23p3. Наличие в валентном слое трех неспаренных электронов приводит к образованию трех связей. Однако, в отличие от элементов II периода, фосфор имеет в валентном слое свободные Зd-орбитали. Поэтому при возбуждении атома фосфора легко достигается состояние с пятью неспаренными электронами ls22s22p63s13p33d1, что позволяет ему образовывать пять связей. Таким образом, фосфор в своих соединениях проявляет валентность 3 и 5. Степень окисления атома фосфора в соединениях может меняться от -3 до +5:

В природе фосфор встречается только в формах, содержащих фосфат-анион Р04(3-). Это обусловлено тем, что фосфор образует с кислородом более прочные связи, чем с другими органогенами В организме фосфор встречается только в виде фосфатов, неорганических и органических. Все они имеют тетраэдрическук структуру, в которой атом фосфора расположен в центре тетраэдра, а атомы кислорода - в его вершинах.
Фосфаты в живых организмах играют две ключевые роли, Во-первых, они служат структурными компонентами скелета, клеточных мембран и нуклеиновых кислот. Костная ткань построена главным образом из гидроксиапатита Са5(Р04)3ОН. Основу клеточных мембран составляют фосфолипиды (разд. 20.2). Остов нуклеиновых кислот состоит из рибозо- или дезоксирибо-зофосфатных цепей (разд. 23.4).
Вторая, более оригинальная роль фосфатов, точнее полифосфатов, в организме заключается в аккумуляции и переносе энергии от экзэргонических к эндэргоническим реакциям и процессам (разд. 4.5). Поскольку фосфор в живых системах представлен только фосфатами, рассмотрение свойств фосфорсодержащих соединений ограничим только ими.
Кислотные свойства. Из оксидов фосфора наибольшее значение имеет оксид фосфора(5) Р2О5, проявляющий кислотные свойства и существующий в молекулярной форме Р4О10. Главная особенность оксида Р2О5 - очень большое сродство к воде. Поэтому он часто используется как эффективный осушитель для газов и органических растворителей.
Оксид фосфора(5) может присоединять одну, две, три и более молекул воды. При этом образуются метафосфорная (НРОз), ди-фосфорная, или пирофосфорная (Н4Р2О7), ортофосфорная (Н3РО4) и полифосфорные кислоты (Р2О5 • nH2 О):

 |
Самое замечательное свойство этих кислот - способность превращаться друг в друга в результате гидролиза (присоединения воды) или в результате дегидратации (потери воды). При дегидратации фосфаты могут образовывать ди- или полифосфаты, характерной особенностью которых является наличие в их молекулах одной или нескольких ангидридных групп:
Общая формула неорганических полифосфатов H(P02)n(OH)n+1, а органических - R(P02)n(OH)n+1, где п - степень конденсации.
Ортофосфорная кислота Н3Р04 — трехосновная кислота: 
Она образует средние (Nа3Р04) и кислые (Na2HP04 и NaH2P04) соли. В водных растворах соли ортофосфорной кислоты гидролизуются. При этом дигидрофосфаты дают кислую среду 4 < рН < 6, гидрофосфаты - слабощелочную 7 < рН < 9, а средние фосфаты - щелочную рН > 11,5. Совокупность кислых фосфатов НРО4(2-) и Н2РО4(-) образует в крови фосфатную буферную систему (разд. 8.5), которая вместе с другими буферными системами обеспечивает постоянство рН крови. Ортофосфорная кислота и труднорастворимые фосфаты алюминия АlР04 и цинка Zn3(P04)2 входят в состав фосфат-цементов, применяемых в стоматологии в качестве пломбировочного материала.
Основным минеральным компонентом костной ткани является гидроксифосфат кальция Са5(Р04)3ОН, называемый гидроксиапатитом. Образование малорастворимого Са5(Р04)3ОН можно выразить общим уравнением (разд. 11.4):

Следовательно, формирование костной ткани в организме является результатом протекания взаимопротивоположных реакций минерализации (осаждения) и деминерализации (растворения) кости. Но эти две взаимообратные реакции происходят в разных клетках: минерализация - в остеобластах, а деминерализация - в остеокластах. Обмен фосфора в организме тесно связан с обменом кальция, но эта связь антагонистична. При увеличении содержания кальция в крови наблюдается уменьшение содержания фосфатов, прежде всего неорганических.
Анионы ортофосфорной кислоты в результате ферментативных реакций фосфорилирования различных биосубстратов образуют органические фосфаты ROPO(OH)2, которые в тканях обычно полностью ионизованы:

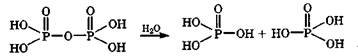 |
Дифосфорная кислота Н4Р2О7 ~ хорошо растворима в воде и в растворе постепенно (а при нагревании - быстрее) превращается в ортофосфорную кислоту в результате гидролиза по ангидридной группе:
В тканях эта реакция катализируется пирофосфатазой. Дифосфорная кислота является более сильной, чем ортофосфорная, в соответствии с общим правилом увеличения силы кислот при их конденсации. Особенно легко удаляются первые два протона:  Кислотные свойства органических полифосфатов R(PO2)n(0H)n+1 подобны свойствам дифосфорной кислоты, но их полная нейтрализация происходит в среде близкой к нейтральной (рН < 8). Поэтому фосфатные группы полифосфатов АТФ и АДФ в условиях организма находятся почти полностью в ионизованном состоянии АТФ-4 и АДФ3- (полианионы). Фосфатные группы нуклеиновых кислот и других органических фосфатов в условия организма также ионизованы практически полностью.
Кислотные свойства органических полифосфатов R(PO2)n(0H)n+1 подобны свойствам дифосфорной кислоты, но их полная нейтрализация происходит в среде близкой к нейтральной (рН < 8). Поэтому фосфатные группы полифосфатов АТФ и АДФ в условиях организма находятся почти полностью в ионизованном состоянии АТФ-4 и АДФ3- (полианионы). Фосфатные группы нуклеиновых кислот и других органических фосфатов в условия организма также ионизованы практически полностью.
Комплексообразующие свойства. Анионы неорганических и органических фосфатов являются довольно жесткими лигандами, поэтому они образуют комплексы преимущественно с жесткими комплексообразователями. Так, во внутриклеточной жидкости АТФ и АДФ присутствуют главным образом в виде комплексов с магнием МgАТФ2-, MgАДФ-. Эти комплексы являются активной формой АТФ в ферментативных реакциях фосфорилирования различных биосубстратов с образованием органических фосфатов. Активация нуклеиновых кислот происходит за счет образования ими по фосфатным группам довольно лабильных комплексов с внутриклеточными катионами К+ и Mg2+.
 |
Макроэргические свойства полифосфатов. Особого внимания заслуживают соединения, содержащие ангидридные группы, например аденозинтрифосфат (АТФ) и аденозиндифосфат (АДФ). В ангидридной группе связи Р—О имеют большую длину, а атомы фосфора несут значительный частичный положительный заряд, что делает эту группу удобной для атаки нуклеофилом по атому фосфора. В качестве нуклеофила могут выступать: Н2О: при реакции гидролиза,
 при этерификации илипри
при этерификации илипри  аммонолизе. Этой атаке способствует также то, что полифосфатный фрагмент АТФ связан в комплекс с катионом магния и что атом фосфора содержит свободные Зd-орбитали, готовые принять электронную пару нуклеофила. В организме, где среда водная, чаще всего протекает реакция гидролиза АТФ, сопровождаемая разрывом связи Р—О в ангидридной группе и выделением энергии. Поэтому связь Р—О называют макроэргической связью и часто обозначают волнистой линией:
аммонолизе. Этой атаке способствует также то, что полифосфатный фрагмент АТФ связан в комплекс с катионом магния и что атом фосфора содержит свободные Зd-орбитали, готовые принять электронную пару нуклеофила. В организме, где среда водная, чаще всего протекает реакция гидролиза АТФ, сопровождаемая разрывом связи Р—О в ангидридной группе и выделением энергии. Поэтому связь Р—О называют макроэргической связью и часто обозначают волнистой линией:  Непосредственно разрыв макроэргической связи, как и любой связи, требует затраты энергии, но за счет энергии, выделяющейся при гидролизе и гидратации образующихся частиц АДФ и Н2РО4(-), это превращение АТФ в целом сопровождается выделением энергии:
Непосредственно разрыв макроэргической связи, как и любой связи, требует затраты энергии, но за счет энергии, выделяющейся при гидролизе и гидратации образующихся частиц АДФ и Н2РО4(-), это превращение АТФ в целом сопровождается выделением энергии:  кДж/моль (разд. 4.5).
кДж/моль (разд. 4.5).
Концентрация АТФ в клетках поддерживается на относительно постоянном уровне, поскольку скорость его образования приблизительно уравновешивается скоростью его гидролиза. Всего в организме человека около 30 г АТФ, и чтобы удовлетворить потребности организма в химической энергии вся АТФ организма в течение суток должна десятки тысяч раз прогидролизоваться до АДФ и фосфата с последующим ресинтезом. Тким образом, концевые фосфатные группы молекул АТФ претерпевают непрерывное обновление в процессах метаболизма. Они постоянно отщепляются и замещаются новыми за счет ортофосфат-анионов клетки.
Образование АТФ в клетке в основном происходит в митохондриях за счет энергии, выделяющейся при биологическом окислении (разд. 9.3.6). Энергия гидролиза АТФ является главной энергетической валютой, обеспечивающей круговорот энергии в клетках.
Окислительно-восстановительные свойства. Поскольку в фосфатах атом фосфора имеет наивысшую степень окисления (+5), то он может выступать только окислителем. Однако эти свойства для фосфатов в условиях организма не характерны. В то же время при гниении трупов в отсутствие кислорода за счет восстановления фосфатов образуется фосфин РНз. Фосфин очень ядовит, но легко окисляется на воздухе. Эта реакция сопровождается даже воспламенением, что является причиной появления огоньков над старыми могилами.
Круговорот фосфора в природе осуществляется посредством фосфатов, поэтому он не сложен, так как не сопровождается изменениями степени окисления атома фосфора. Значительная часть фосфора рано или поздно попадает в океан и откладывается в виде фосфатов в осадочных породах (рис. 12.5).
Общая характеристика и биологическая роль тяжелых элементов группы VA. В группе VA кроме азота и фосфора находятся

Рис. 12.5. Круговорот фосфора в природе
их электронные аналоги - ns2np3-элементы: мышьяк As, сурьма Sb и висмут Bi, содержание которых в организме человека составляет около 10-6 %. Висмут - металл, а для As и Sb характерны две модификации: одна неметаллическая, другая металлическая, более устойчивая. Для этих элементов в соединениях характерны степени окисления -3, +3 и +5.
Водородсодержащие соединения: арсин АsН3, стибин SbН3, висмутин BiH3 - газообразные неустойчивые вещества, проявляющие сильные восстановительные и токсические свойства. Арсин прежде всего поражает оксигемоглобин, способствуя активации связанного в нем кислорода, который окисляет не только арсин, но и гемоглобин в метгемоглобин:

Таким образом, арсин представляет собой яд гемолитического действия, и при отравлениях им рекомендуется переливание крови.
Определение мышьяка в биологическом материале проводят по реакции Марша. Для этого к биоматериалу добавляют цинк и соляную кислоту, выделяющийся при этом водород восстанавливает любое соединение мышьяка до арсина, который при нагревании разлагается с образованием на стенках стеклянной трубки блестящего налета мышьяка ("мышьяковое зеркало"):
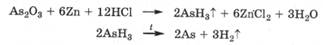
Аналогично определяют наличие в биоматериалах сурьмы и висмута.
Оксиды и гидроксиды As(III), Sb(III) и Bi(III) - амфотерные соединения. При этом в соответствии с общей закономерностью у производных мышьяка преобладают кислотные свойства, а у соединений висмута - основные свойства. Мышьяковистая кислота в водных растворах может находиться в ортоформе H3AsO3 и мтаформе HAs02, а соответствующие соли называют ортоарсенитами (Nа3АsО3, K3ASO3) и метаарсенитами (NaAs02, КАsО2).
Соединения мышьяка (III) очень токсичны. Механизм токсического действия объясняют способностью мышьяка блокировать тиоловые группы (-SH) ферментов и других биологических субстратов:

 |
Еще эффективней соединения мышьяка взаимодействуют с 1,2-ди-тиолами, так как при этом образуются циклические дитиоарсениты, которые значительно стабильнее:
Поэтому унитиол CH2(SH)CH(SH)CH2S03Na и другие 1,2-ди-тиолы являются эффективными антидотами при отравлениях мышьяком.
Мышьяк является кроме того антиметаболитом элементов: фосфора, селена и иода. Так, известно, что в районах, где отмечено повышенное содержание мышьяка, он накапливается в щитовидной железе, угнетает ее функцию и вызывает эндемический зоб. Смертельная доза для человека составляет 0,1 - 0,3 г мышьяка. Интересно, что организм может привыкать к мышьяку, если вводить его соединения, постепенно увеличивая дозу. В медицинской практике используют AS2O3 для омертвления (некротизации) мягких тканей зуба. В то же время соединения мышьяка не только убивают, но и помогают в борьбе за жизнь. Так, при малокровии, истощении и нервозности назначают мышьяковые препараты (AS2O3, K3As03) в микродозах (0,001 г на прием).
Особенностью солей Sb3+ и Bi3+ является их гидролиз в водной среде с образованием оксокатионов (ВiO+ - висмутил):

Препарат висмута нитрат основной BiONOз широко применяют в медицине в качестве дезинфицирующего, уничтожающего запахи и одновременно вяжущего средства. Его используют при желудочных и кишечных заболеваниях, особенно при дизентерии и холере. Механизм действия этого препарата, вероятно, связан с его кислотно-основными и комплексообразующими свойствами, а также с гетерогенными процессами осаждения и отслоения в водных системах (разд. 11.4), которые он может вызывать.
Из соединений As(V), Sb(V), Bi(V) наиболее устойчивы соединения мышьяка. AS2O5 - кислотный оксид, которому соответствует мышьяковая кислота Н3А3О4, хорошо растворимая в воде и по силе близкая к Н3РО4. Соли мышьяковой кислоты - арсенаты (Na3As04, K3As04). Арсенат-ионы, будучи аналогами фосфатов, легко проникают в клетки по транспортным системам фосфатов. Они могут конкурировать с фосфатами в процессах этерификации и окислительного фосфорилирования в митохондриях, выступая ингибиторами ферментов, обеспечивающих эти процессы. В отличие от фосфатов, которые устойчивы к восстановлению и не токсичны, соединения мышьяка(5) токсичны, так как в организме человека легко восстанавливаются до соединений As(III) под действием сульфидов или тиолов:

Образующиеся арсениты являются токсичными соединениями, блокирующими тиоловые группы биосубстратов.
Таким образом, мышьяк, сурьма и висмут постоянно присутствуют в живых организмах, но их физиологическая и биохимическая роль пока практически не выяснена. В то же время соединения этих элементов обладают высокой токсичностью.
Дата публикования: 2014-10-16; Прочитано: 3161 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
