 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
СЕРА И ЕЕ СОЕДИНЕНИЯ
|
|
В периодической системе сера расположена в III периоде, в группе VIA. Электронная конфигурация ее атома ls22s22p63s23p4. Наличие во внешнем слое двух неспаренных электронов позволяет атому серы образовывать две связи. Однако, в отличие от кислорода, у атома серы на валентном уровне имеется пять свободных d-орбиталей. Поэтому при возбуждении у атома серы могут возникать состояния с четырьмя неспаренными электронами 3s23p33d1 и с шестью неспаренными электронами 3s13p33d2, которые позволяют сере образовывать 4 и 6 связей соответственно. Максимальная степень окисления серы в соединениях +6 (SO3, H2S04, R-OSO3H, а минимальная -2 (H2S, R—SH, R—S—R). В серосодержащих биосубстратах организма сера обычно имеет минимальную степень окисления (-2), что способствует высо кой восстановительной активности этих соединений, особенно соединений, содержащих тиольную группу (R—SH). Эта группа легко окисляется в дисульфидную группу (R—S—S—R), содержащую атомы серы со степенью окисления —1.
Большой радиус атома серы, невысокая электроотрицательность (ОЭО = 2,5), наличие внутреннего электронного экрана 2s22p6 и вакантных Зd-орбиталей во внешнем слое способствуют уменьшению энергии серосодержащих связей и увеличивают поляризуемость как связей, так и неподеленных пар электронов внешнего слоя. Все это делает атом серы в соединениях чрезвычайно мягким центром, склонным к взаимодействию прежде всего с мягкими легкополяризуемыми реагентами, а также к образованию связей с аналогичным атомом серы (R—S—S— R).
Кислотно-основные свойства. Высокая поляризуемость (мягкость) атома серы объясняет низкое сродство ее соединений с общей формулой R—SH к протону - самому жесткому из реагентов:

Это проявляется, как видно из приведенных данных, в резком уменьшении основности и увеличении кислотности серосодержащих соединений по сравнению с кислородными аналогами.
Высокая поляризуемость электронной оболочки атома серы сказывается также на окислительно-восстановительных, комплексообразующих и нуклеофильных свойствах серосодержащих соединений.
Окислительно-восстановительные свойства. Из всех органогенов только сера в степени окисления -2 окисляется легче, чем углерод органических соединений. Поэтому защитные свойства относительно окислителей и активных радикалов проявляют прежде всего тиолы R—SH. При мягком окислении тиолов происходит образование дисульфидов:

Этот процесс в условиях организма носит обратимый характер, о чем свидетельствует значение его нормального восстановительного потенциала.
Свободную тиольную группу содержит а-аминокислота цистеин, которая при мягком окислении переходит в цистин:

Цистеинсодержащие белки в результате подобного окисления образуют дисульфидные связи, вследствие чего изменяются их конформация и биологические функции. В организме роль протекторов цистеинсодержащих белков выполняют глютатион (G—SH), являющийся трипептидом, содержащим цистеин, и дигидролипоевая кислота, которые принимают на себя действие окислителя и таким образом защищают чувствительные белки. Окисление этих протекторов происходит по-разному: для глютатиона оно протекает межмолекулярно, сшивая его две молекулы дисульфидным мостиком, а для дигидролипоевой кислоты -внутримолекулярно с образованием липоевой кислоты:

Поскольку эти процессы носят обратимый характер, то они позволяют поддерживать в организме тиол-дисульфидное равновесие, которое лежит в основе регуляции активности ферментов и гормонов, проницаемости мембран, свертывания крови и адаптации организма к экстремальным воздействиям.
При появлении в клетке радикалов  вследствие неферментативного окисления или радиационного воздействия, тиоловые протекторы, взаимодействуя с этими радикалами, нейтрализуют их. При этом появляются тиоловые радикалы, менее активные и склонные к самоликвидации за счет образования дисульфидов:
вследствие неферментативного окисления или радиационного воздействия, тиоловые протекторы, взаимодействуя с этими радикалами, нейтрализуют их. При этом появляются тиоловые радикалы, менее активные и склонные к самоликвидации за счет образования дисульфидов:

Таким образом, тиоловые протекторы защищают организм и в случае атаки радикалами, но концентрация этих естественных протекторов ограничена. С целью усиления протекторной защиты организма от указанных воздействий используют тиоловые антидоты, содержащие две близко расположенные тиоловые группы (2,3-димеркаптопропанол-1 (БАЛ)) или тио- и аминогруппы (2-амино-З-меркапто-З-метилбутановая кислота (пеницилламин)), а также препараты унитиол и сукцимер (разд. 10.4), используемые в хелатотерапии как лиганды при отравлении ионами тяжелых металлов.

Комплексообразующие свойства. Тиолсодержащие биосубстраты, вследствие большой поляризуемости атома серы, являются мягкими и активными лигандами. Поскольку катионы тяжелых металлов относятся к мягким комплексообразователям, особенно Cu2+, Ag+, Hg2+, то они активно взаимодействуют с тиольными группами многих серосодержащих биосубстратов, включая ферменты (Ф-SH), с образованием прочных комплексов:

В результате субстрат или фермент теряет биологическую активность, поэтому ионы тяжелых металлов являются токсикантами. Детоксикация организма от катионов металлов-токсикантов с помощью хелатотерапии была рассмотрена в разд. 10.5.
Сродство катионов Ag+ к тиольным группам настолько велико, что AgN03 используют для количественного определения содержания в исследуемой пробе групп —SH методом титрования. Это позволяет оценивать буферную емкость антиоксидантной системы организма (разд. 9.3.9).
Нуклеофильные и электрофильные свойства. Большой радиус атома серы и наличие двух неподеленных электронных пар способствуют его высокой поляризуемости. Благодаря этому для тиолов характерна высокая нуклеофильность за счет атома серы. Вследствие высокой нуклеофильности тиоловые биосубстраты чувствительны к действию алкилирующих реагентов, включая такие отравляющие вещества, как люизит и иприт. Действие люизита связано с ингибированием дигидролипоевой кислоты -кофактора оксидазных ферментов:

Защитные свойства от действия люизита проявляют вышеперечисленные тиоловые антидоты (БАЛ, унитиол и др.), которые не только связывают свободные молекулы яда, но и высвобождают дигидролипоевую кислоту из ее комплекса с люизитом.
Вследствие высокой нуклеофильности и повышенной кислотности тиолы легче вступают в реакцию этерификации, чем спирты. Эта особенность тиолов реализуется в природе в случае кофер-мента А, содержащего тиольную группу (HSKoA). Кофермент А при взаимодействии с карбоновыми кислотами в присутствии фермента ацилкоа-синтетазы образует ацилкофермент А:

Этот процесс эндэргонический и поэтому сопряжен с гидролизом АТФ.
В ацилкоферменте А карбонильный атом углерода имеет высокий частичный положительный заряд 8+ и соответственно высокую электрофильность. Это объясняется слабым сопряжением 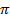 -электронов связи С=0 с неподеленной электронной парой атома серы, что обусловлено его большими размерами. Поэтому данный кофермент выполняет роль переносчика ацильной группы на кислородсодержащие субстраты (разд. 19.2). Например, ацетилкофермент А превращает холин в ацетилхолин:
-электронов связи С=0 с неподеленной электронной парой атома серы, что обусловлено его большими размерами. Поэтому данный кофермент выполняет роль переносчика ацильной группы на кислородсодержащие субстраты (разд. 19.2). Например, ацетилкофермент А превращает холин в ацетилхолин:

Кроме того, ацильная группа в ацилкоферменте А настолько активирована, что при его участии осуществляются реакции расщепления и образования связей С—С в биосубстратах. Благодаря ацил-коферменту А в организме синтезируются жирные кислоты (разд. 19.4.1), стероиды, а в микроорганизмах - различные антибиотики. Высокая нуклеофильность атома серы в аминокислоте ме-тионине (CH3SR) способствует ее реакции с АТФ с образованием S-аденозилметионина, содержащего S-метилсульфониевую группу, в которой атом серы, несущий положительный заряд, является сильным электрофилом:

С помощью этого биосубстрата осуществляется биологическое метилирование аминов. Например, 2-аминоэтанол (коламин), подвергаясь полному метилированию S-аденозилметионином, превращается в холин:

Таким образом, тиоловые субстраты живых систем вследствие высокой поляризуемости атома серы выполняют биохимические функции, участвуя в синтезе метаболитов и поддержании тиол-дисульфидного равновесия в антиоксидантной системе. В то же время они оказываются чрезвычайно чувствительными к внешним воздействиям окислителей, катионов металлов-токсикантов и алкилирующих веществ благодаря специфическим химическим свойствам серосодержащих соединений.
Круговорот серы в природе. По содержанию в природе сера — один из распространенных элементов. В земной коре она присутствует в виде свободной серы, сульфидов и сульфатов (рис. 12.6). Последних много и в гидросфере. Потребности животных в соединениях серы удовлетворяются только за счет растений, которые усваивают ее в основном из почвы в виде сульфатов и включают в состав серосодержащих белков. В результате сжигания ископаемого топлива, загрязненного серой, и плавки сульфидных руд в атмосферу поступают загрязняющие ее оксиды серы (разд. 14.1.1). Оксид серы(4), растворяясь в дождевой воде и окисляясь кислородом воздуха, возвращается кислотными дождями в виде сульфат-ионов в почву и гидросферу (разд. 14.1.3). В круговороте серы большую роль играют аэробные и анаэробные микроорганизмы, которые восстанавливают и окисляют серосодержащие соединения.
Рассмотрим химические свойства важнейших серосодержащих соединений.
Сероводород H2S. При гниении белковых веществ под действием микроорганизмов образуется сероводород. Это бесцветный газ с характерным неприятным запахом. Очень ядовит, так как за счет связывания атомов меди в цитохромоксидазе блокирует перенос электронов с этого фермента дыхательной цепи на кислород. Поэтому при вдыхании сероводорода наступает обморочное состояние и даже смерть от паралича дыхания. Сероводород является составной частью некоторых природных минеральных вод, которые применяются в медицине.
Один объем воды при стандартных условиях растворяет около трех объемов сероводорода (0,1 М раствор H2S). В водном растворе сероводород является очень слабой двухосновной кислотой, диссоциирующей ступенчато:

Сероводородная кислота образует два типа солей: средние - сульфиды (Na2S) и кислые - гидросульфиды (NaHS), которые в водных

Рис. 12.6. Круговорот серы в природе
растворах легко гидролизуются по аниону и поэтому их растворы пахнут сероводородом. Гидролиз сульфидов многозарядных катионов А13+, Сг3+ протекает и по аниону, и по катиону, поэтому он практически необратим (разд. 8.3.1):
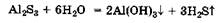
Сульфиды, и особенно сероводород, являются сильными восстановителями и в зависимости от условий могут окисляться до S, S02 или H2SO4:
 |
Восстановительные свойства сероводорода лежат в основе деятельности фотосинтезирующих анаэробных бактерий, продуцирующих из H2S и СO2 углеводыи серу:
 |
Присутствие сероводорода качественно обнаруживают, пропуская воздух через растворы солей свинца или кадмия и наблюдая образование окрашенных осадков сульфидов:
Количественно содержание сероводорода определяют методом иодометрии:
 |
Кислородные соединения серы. Сера с кислородом образует два кислотных оксида: SO2 - оксид серы(4) и SO3 - оксид cepы(6).
При растворении в воде оксид серы(4) образует сложную равновесную систему на основе слабой малоустойчивой сернистой кислоты:

 |
Эта кислота образует два типа солей: средние - сульфиты (Na2SO3, K2SO3) и кислые - гидросульфиты (NaHS03, KHSO3). Растворимые соли сернистой кислоты гидролизуются в водных растворах по аниону:
При нагревании раствора Nа2SО3 с порошком серы образуется тиосульфат натрия, соль очень неустойчивой тиосерной кислоты H2S2O3:
 |
Тиосульфат натрия применяется в медицинской практике как универсальный антидот, свойства которого будут рассмотрены в конце этого раздела.
Окислительно-восстановительные свойства SC2, воздействие его на организм и определение его в воздухе будут рассмотрены в разд. 14.1.
Оксид серы(6) SO3 активно поглощает воду, образуя сильную серную кислоту, которая полностью диссоциирована по первой ступени и в меньшей степени по второй ступени:

Соли серной кислоты — сульфаты и гидросульфаты - в водном растворе не подвергаются гидролизу по аниону. Многие сульфаты хорошо растворимы в воде и применяются в качестве лекарственных препаратов: Na2S04 • 7Н20 - глауберова соль, MgS04 * 7Н2О -горькая соль, CuS04 • 5Н2О - медный купорос, ZnS02 • 7Н20 -цинковый купорос. Практически нерастворимы BaS04, SrS04, PbS04. Сульфат бария BaS04 применяется как контрастное вещество при рентгенологическом исследовании пищевода и желудка, так как хорошо поглощает рентгеновское излучение.
 |
При жестком окислении серосодержащие субстраты могут окисляться до сульфатов. Образующаяся в организме эндогенная серная кислота участвует в обезвреживании ядовитых соединений фенола, крезола, индола, вырабатываемых в кишечнике из аминокислот микробами. С этими соединениями серная кислота образует эфиры сульфаты, которые выводятся из организма с мочой:
Соли серной кислоты практически не являются окислителями, но сама серная кислота активно проявляет окислительные свойства. В разбавленных растворах серная кислота - окислитель за счет катионов водорода, которые восстанавливаются до элементарного водорода. Концентрированная серная кислота является окислителем за счет S+6, окисляя металлы и неметаллы и превращаясь при этом в SO2, S или H2S, в зависимости от свойств партнера по реакции и условий ее проведения.
Тиосульфат натрия Na2S2O3. Поскольку один из атомов серы в тиосульфат-ионе эквивалентен атому кислорода, считают, что его степень окисления равна -2, а степень окисления центрального атома серы +6 (как в  сульфате). Формальные же степени окисления этих атомов серы равны 0 и +4 соответственно. Тиосульфат-ион проявляет окислительно-восстановительную двойственность, является активным лигандом в реакциях комплексообразования, для него характерны также реакции осаждения. Эти особенности объясняют, почему тиосульфат натрия применяется в медицине как один из универсальных антидотов.
сульфате). Формальные же степени окисления этих атомов серы равны 0 и +4 соответственно. Тиосульфат-ион проявляет окислительно-восстановительную двойственность, является активным лигандом в реакциях комплексообразования, для него характерны также реакции осаждения. Эти особенности объясняют, почему тиосульфат натрия применяется в медицине как один из универсальных антидотов.
 |
При отравлениях галогенами и другими сильными окислителями антитоксическое действие Na2S2O3 объясняется его восстановительными свойствами. При этом сильными окислителями тиосульфат окисляется до сульфат-иона, а слабыми - до тетратионат-иона:
Последняя реакция широко используется в объемном анализе в методе иодометрии.
При отравлениях цианидами антитоксическое действие Na2S2O3 объясняется его окислительными свойствами. Он окисляет цианид-ион в значительно менее ядовитый тиоцианат-ион:

При подкислении водных растворов тиосульфатов происходит разложение образующейся неустойчивой тиосерной кислоты:

Данная реакция используется для лечения больных чесоткой, так как образующиеся сера и оксид cepы(4) оказывают противопаразитарное действие.
Тиосульфат-ион образует прочные комплексные соединения со многими катионами металлов-токсикантов: кадмия, меди(1), ртути(2), свинца(2), серебра. С катионами серебра он образует прочный водорастворимый комплекс, в котором ионы серебра связаны сильней, чем в нерастворимых галогенидах серебра:

Поэтому тиосульфат натрия широко используется при обработке кино- и фотопленок, а также рентгеновских снимков в качестве фиксажа для закрепления изображения путем удаления остаточных галогенидов серебра из обрабатываемых материалов. Эффективность тиосульфата натрия при отравлениях свинцом и ртутью связана не только с реакцией комплексообразования, но и с образованием плохо растворимых нетоксичных соединений: тиосульфатов, сульфитов и сульфидов этих металлов.
 |
Общая характеристика и биологическая роль тяжелых элементов группы VIA. Селен Se и теллур Те - элементы неметаллического характера, а полоний Ро - металл и очень редкий радиоактивный элемент. В соединениях эти элементы проявляют степени окисления -2, +4 и +6, последняя для полония не характерна. Устойчивость соединений этих элементов в различных степенях окисления изменяется следующим образом:
Селен физиологически активен, а биологическое действие теллура и полония (без учета его радиоактивности) не выявлено. В живых организмах селен, как и сера, входит в состав биосубстратов в степени окисления -2. Вследствие близости химических свойств этих элементов они могут замещать друг друга в соединениях. При этом селен может выступать как синергистом, так и антагонистом серы, о чем свидетельствует биологическая активность селенсодержащих соединений.
При поступлении в организм селен прежде всего накапливается в ногтях и волосах. Их основу составляют серосодержащие аминокислоты цистеин и метионин. Селен замещает атомы серы в этих аминокислотах, превращая их в селеноцистеин и селенометионин. Эти необычные кислоты также входят в состав активных центров следующих ферментов: глютатионпероксидазы, глютатионредуктазы и формиатдегидрогеназы, обеспечивая их высокую ферментативную активность. Хорошо известна способность селена предохранять организм от отравления ртутью и кадмием. Причем связывание катионов этих токсичных металлов происходит не селенсодержащими группами метаболитов, а другими активными центрами, которые мало влияют на биологическую активность метаболитов. Интересным является также факт взаимосвязи между низкой смертностью от рака и высоким содержанием селена в пище. В то же время замещение группы SH на группу SeH в ряде ферментов приводит к снижению их дегидрогеназной активности и ингибированию клеточного дыхания.
Соединения, содержащие Se+4, - селениты - более токсичны, чем цианиды. Это, вероятно, вызвано их окислительными свойствами, из-за которых происходит превращение тиолсодержащих белков (Prot SH) в белки, содержащие группы —S—Se—S—:

Наличие такой группы может привести к изменению третичной структуры белков и нарушению их биологической функции.
Дата публикования: 2014-10-16; Прочитано: 4687 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
