 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Магний и кальций
|
|
В организме взрослого человека содержится катионов магния около 20 г, а кальция - 1000 г. Половина количества катионов магния и почти 99 % кальция находится в костной ткани, остальное - в мягких тканях. Суточная потребность в катионах магния составляет около 0,3 г, кальция - 1 г, причем у женщин в период беременности потребность в катионах кальция возрастает в 3-4 раза.
Магний и кальций - элементы ПА группы периодической системы. Атомы элементов этой группы имеют во внешнем слое два электрона на s-подуровне (12Mg: 3s2; 20Cа: 4s2), которые они стремятся отдать в соединениях партнеру. При этом они образуют двухзарядные катионы Mg2+ и Са2+ с электронной конфигурацией ближайшего благородного газа. Однако, в отличие от соединений элементов IA группы, свойства соединений ПА группы при движении сверху вниз изменяются более резко. Так, оксид и гидроксид бериллия амфотерны, оксид и гидроксид магния несильно проявляют основные свойства и практически нерастворимы в воде, а оксиды и гидроксиды кальция, стронция, бария и радия растворимы в воде с образованием сильнощелочной среды, и поэтому они называются щелочноземельными металлами.
 |
Различие в свойствах катионов магния и кальция в водной среде связано с различием в плотности положительного заряда на их поверхности. Поскольку катион Mg2+ имеет меньший радиус, чем Са2+ (66 и 99 пм соответственно), то он гидратируется лучше, а кроме того, его свободные атомные орбитали внешнего уровня, включая Зd-орбитали, способны взаимодействовать с неподеленными парами электронов молекул воды, образуя достаточно устойчивые аквакомплексы [Mg(H20)6]2+. Поэтому в гидратной оболочке катиона магния молекулы воды удерживаются (т = 7 • 10-5 с) значительно сильнее, чем в гидратной оболочке катиона кальция (т = 2 • 10-8 с). Эти данные указывают на большую способность катиона магния образовывать ковалентные связи по сравнению с катионом кальция. В связи с этим катионы магния, в отличие от катионов кальция, способны к гидролизу
Хотя комплексообразующая способность катиона магния больше, чем у катиона кальция, но и Са2+, в отличие от катионов К+ и Na+, образует достаточно прочные комплексы с аминокислотами и белками. Причем катион Mg2+ более жесткий комплексообразователь, а Са2+ - более мягкий, поэтому Mg2+ больше "любит" кислород- и фосфатсодержащие лиганды, а Са2+ -кислород- и азотсодержащие лиганды. Именно склонность к комплексообразованию является характерной особенностью этих катионов в условиях организма.
Основная масса катионов магния, находящегося вне костей, сосредоточена внутри клеток. Ионы магния играют важную роль в поддержании осмотического давления внутри клеток. Основная масса магния в крови содержится в ионизованной форме, т. е. в виде акваиона (55-60 %), приблизительно 30 % связано с белками, а 10-15 % входит в состав комплексных соединений с фосфолипидами и нуклеотидами.
Катионы магния за счет комплексообразования являются одним из основных активаторов ферментативных процессов. Так, они активируют ферменты окислительного фосфорилирования, репликации ДНК и минерализации костной ткани. Кроме того, с помощью катионов магния формируются рибосомы из РНК и белков и в них активируется процесс синтеза белков. Во внутриклеточной жидкости ионы Mg2+ образуют комплексы с анионами АТФ и АДФ, которые являются активной формой этих субстратов, способствуя их активному гидролизу, сопровождающемуся выделением энергии, а также участию в реакциях фосфорилирования:
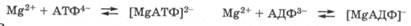
Все эти данные свидетельствуют о большом сродстве катионов Mg2+ к атомам кислорода фосфатов.
В то же время катионы Mg2+ комплексуются и с атомами азота. Так, в хлорофилле растений Mg2+ занимает центральное место в порфириновом лиганде, образуя с его четырьмя атомами азота четыре связи. За счет комплексообразования магния с белками происходит активация многих ферментов.
Ионы магния подавляют в мозгу центры регуляции дыхания и кровеносных сосудов, вызывая понижение артериального давления крови. Они также способствуют выведению холестерина из организма, усилению перистальтики кишечника и секреции желчи.
В отличие от ионов магния, катионы кальция преимущественно сосредоточены в межклеточных жидкостях. Обмен кальция в организме контролируется гормонами паращитовидных и щитовидной желез, а также витамином D. При понижении концентрации ионов Са2+ в плазме крови интенсифицируется выделение гормона паращитовидных желез, под влиянием которого остеокласты усиливают растворение минеральных соединений в костях, что повышает содержание Са2+ в плазме крови. В свою очередь, при увеличении уровня Са2+ в плазме крови гормон щитовидной железы активирует работу остеобластов по отложению кальция в костной ткани. Поступление кальция из пищи осложняется плохим его всасыванием из-за образования в желудочно-кишечном тракте практически нерастворимых фосфата кальция Са3(Р04)2 и кальциевых солей жирных кислот Ca(CnH2n+1COO)2. В процессах всасывания кальция из желудка и кишечника существенную роль играет витамин D.
Основным минеральным компонентом костной ткани является гидрофосфат кальция Са5(Р04)3ОН (гидроксоапатит). Костная ткань обеспечивает поддержание концентрации ионов Са2+ в биологических жидкостях на определенном уровне, поэтому ее можно рассматривать как кальциевый буфер организма. Процессы обмена кальция с участием костной ткани были подробно рассмотрены в разд. 11.4.
Костная ткань содержит в небольших количествах катионы практически всех металлов, встречающихся в организме, выполняя функцию минерального депо. В заметных количествах в костную ткань включаются все элементы группы ПА, из которых катионы Ве2+, Sr2+ и Ва2+ приводят к патологическим изменениям (разд. 11.4). Из дополнительных анионов костная ткань может содержать карбонат- и фторид-ионы, последний входит в состав зубной эмали (Ca5(P04)3F). Замена гидроксогруппы на фторид-анион значительно повышает твердость и снижает растворимость костной ткани.
Ионы кальция участвуют в передаче нервного импульса, сокращении мышц, регуляции сердечного ритма, а также в процессе свертывания крови, активируя превращение протромбина в тромбин и ускоряя превращение фибриногена в фибрин, что способствует агрегации тромбоцитов. Катионы кальция понижают возбудимость ЦНС, поэтому уменьшение их содержания в организме проявляется в судорогах. Ионы кальция влияют на кислотно-основной баланс организма, действие эндокринных желез, а также обладают противовоспалительным и антиаллергическим действием. Они являются биологическими антагонистами ионов натрия, калия и магния.
Общая концентрация ионов кальция в плазме крови составляет 2,5* 10-3 М, из них 40 % связано в комплексы с белками, 14 % - в комплексы с лактатами и цитратами и 46 % находится в ионизованной форме. При высокой концентрации ионизованного кальция в плазме (гиперкальциемия) назначают внутрь фосфат натрия, который предотвращает всасывание кальция, поступающего с пищей. Если концентрация в плазме превысит 3,75*10-3 М, то, учитывая опасность остановки сердца, немедленно вводят внутривенно смесь фосфатов натрия и калия. Для связывания кальция также используются соли лимонной кислоты (цитрат натрия), которые предотвращают свертывание крови при ее консервации на станциях переливания крови. В народной медицине лимоны применяют для уменьшения отложения солей.
В медицинской практике используются следующие соединения магния и кальция.
Оксид магния MgO (жженая магнезия), основной карбонат магния Mg(OH)2 • 4MgC03 • Н20 (белая магнезия), кальция карбонат СаС03 (мел осажденный) являются основными антацидными средствами, применяемыми для уменьшения кислотности желудочного сока.
Магния сульфат MgS04 • 7Н20 (горькая соль или магнезия) используется при гипертонии как слабительное и желчегонное средство, а также как успокаивающее средство для ЦНС.
Кальций хлористый СаС12 • 6Н20 применяют как противовоспалительное и антиаллергическое средство, для снятия сердечно-сосудистого спазма, для улучшения свертывания крови, при переломах костей и ревматизме.
Органические соединения кальция: глютаминат, глюконат, глицерофосфат, аденозинтрифосфат, пантотенат и пангамат Са применяются как общеукрепляющие средства.
Гипс 2CaSO4 * Н20 широко используется в травматологической и стоматологической практике, так как при замешивании его с водой образуется нерастворимый CaS04 • 2Н20:

В результате происходит быстрое затвердение с некоторым увеличением объема, что используется для фиксации при переломах костей и получения хороших слепков в стоматологии.
Дата публикования: 2014-10-16; Прочитано: 7500 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
