 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
АЗОТ И ЕГО СОЕДИНЕНИЯ
|
|
В периодической системе азот находится во II периоде, в группе VA. Электронная конфигурация его атома - ls22s22p3. Наличие во внешнем слое атома азота трех неспаренных электронов обеспечивает образование им трех связей в соединениях. Высокое значение энергии ионизации (1400 кДж/моль) и небольшой радиус атома (52 пм) способствуют ковалентному характеру этих связей. Однако из-за наличия во внешнем слое неподеленной пары электронов атом азота может образовывать еще одну связь (четвертую) по донорно-акцепторному механизму, выступая донором электронной пары. Электронодонорная способность атома азота в соединениях зависит от типа орбитали, на которой находится электронная пара (разд. 23.1), и является его главной отличительной чертой, выделяя азот среди других органогенов.
В то же время для атома азота характерна очень высокая электроотрицательность (ОЭО = 3,1), что указывает на полярный характер азотсодержащих связей. В бинарных соединениях с любыми элементами, кроме кислорода и фтора, атом азота имеет отрицательную степень окисления. Степень окисления атома азота может изменяться от -3 до +5:

В азотсодержащих метаболитах атомы азота имеют степень окисления -3, поскольку они связаны с атомами водорода и углерода, которые имеют меньшую электроотрицательность. Растения и некоторые микроорганизмы способны усваивать молекулярный азот и соединения, в которых азот имеет степень окисления +4 и +5. В результате усвоения этих азотсодержащих продуктов происходит восстановление азота до степени окисления -3.
Азот и его круговорот в природе. Азот - основной компонент воздуха: его объемная доля равна 78,2 %. Молекула азота N2 чрезвычайно устойчива (Eсв = 940 кДж/моль), так как между образующими ее атомами имеется три связи (одна  - и две
- и две 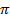 - связи). Высокая устойчивость молекулы азота делает его практически инертным при обычной температуре. Только при очень высоких температурах он соединяется с водородом, образуя аммиак, и с кислородом, образуя смесь различных оксидов. Во вдыхаемом воздухе азот служит полезным разбавителем кислорода. Однако, вследствие растворения азота в крови, при резком снижении окружающего давления возможно возникновение кессонной болезни (разд. 26.3).
- связи). Высокая устойчивость молекулы азота делает его практически инертным при обычной температуре. Только при очень высоких температурах он соединяется с водородом, образуя аммиак, и с кислородом, образуя смесь различных оксидов. Во вдыхаемом воздухе азот служит полезным разбавителем кислорода. Однако, вследствие растворения азота в крови, при резком снижении окружающего давления возможно возникновение кессонной болезни (разд. 26.3).
 |
Из-за высокой стабильности молекулярного азота большинство живых существ не усваивают его. В то же время азот -необходимый компонент аминокислот, белков и нуклеиновых кислот. Процесс усвоения газообразного азота называется фиксацией азота. Этот процесс в природе совершается двумя путями (рис. 12.4). Основной путь - за счет жизнедеятельности азотфиксирующих бактерий в симбиозе с бобовыми растениями, а также синезеленых и пурпурных водорослей. Эти микроорганизмы превращают молекулярный азот в аммиак или ионы NH4(+) под действием фермента нитрогеназы, использующего энергию гидролиза АТФ:
Образующийся аммиак в результате жизнедеятельности нитрифицирующих бактерий окисляется под действием кислорода
 |
Рис. 12.4. Круговорот азота в природе
и фермента нитрогеноксидазы в нитраты, которые легко усваиваются корнями растений из почвы.

Другой путь фиксации азота осуществляется во время грозы, когда при электрическом разряде (молния) происходит взаимодействие атмосферных азота и кислорода с последующим образованием нитратов, которые с дождевой водой попадают в почву и водоемы:

 |
Растения усваивают нитраты, восстанавливая их с помощью нитратредуктазы в ионы аммония:
Ионы аммония в растениях благодаря реакции восстановительного аминирования образуют глутаминовую кислоту. На базе этой аминокислоты в результате реакции трансаминирования (разд. 21.2) получаются остальные девятнадцать ос-аминокислот, используемые для синтеза необходимых азотсодержащих биосубстратов: белков, нуклеиновых кислот и других.
 |
Животные используют растения как источник азотсодержащих биосубстратов, из которых они синтезируют свои белки и нуклеиновые кислоты. После гибели и последующего разложения растительных и животных организмов из них образуются аммиак и соли аммония. На этом замыкается малый цикл в круговороте азота. Большой цикл в круговороте азота замыкается в результате жизнедеятельности денитрифицирующих анаэробных бактерий почвы, которые восстанавливают нитраты под действием фермента нитротазы до элементарного азота, который возвращается в атмосферу:
Таким образом, круговорот азота осуществляется благодаря жизнедеятельности различных микроорганизмов, растений и животных. Деятельность человека, связанная с производством и использованием аммиака и нитратсодержащих минеральных удобрений, вносит заметный вклад только в одну ветвь круговорота азота, связанную с его фиксацией. Поэтому требуется строгий контроль за содержанием нитратов в почве, чтобы не допустить нарушения естественного круговорота азота в природе.
Аммиак NH3 в организме человека является одним из продуктов дезаминирования аминокислот, белков, биогенных аминов, пуриновых и пиримидиновых оснований, поступающих с пищей. Это простейший азотсодержащий метаболит, химические свойства которого обусловлены специфическими свойствами атома азота в соединениях.
Аммиак - бесцветный газ с резким запахом. В молекуле аммиака атом азота образует четыре гибридные орбитали sp3, направленные к вершинам тетраэдра, три из которых заняты атомами водорода, а четвертая - неподеленной парой электронов. Длина каждой связи 101,4 пм, энергия связи 390,4 кДж/моль, дипольный момент молекулы 1,47 Д.
Вследствие большой полярности молекулы аммиака в 1 объеме воды при 293 К растворяется около 700 объемов аммиака (31 моль/л). При этом образуется концентрированный 25 % водный раствор. В водном растворе аммиак в основном находится в виде гидрата NH3*H20 (разд. 10.3), который в кислой среде образует ион аммония, а в нейтральной и слабощелочной среде обратимо диссоциирует с образованием ионов аммония и гидроксила: 
В сильнощелочной среде аммиак необратимо удаляется из раствора.
В крови при рН =7,4 гидрат аммиака с учетом величины его pKa(BH+) = 9,25 на 98,6 % будет находиться в виде ионов аммония. Несмотря на большой избыток, ионы аммония не могут проникать через клеточные мембраны, однако молекулы NH3 легко проходят через мембраны и могут воздействовать на организм, прежде всего на мозг, что и используется в медицинской практике при выводе человека из обморочного состояния. Аммиак - токсичный газ, поражающий при вдыхании слизистые дыхательных путей, вызывая одышку и воспаление легких.
 |
В медицинской практике при алкалозе (разд. 8.5) в качестве мочегонного средства применяют хлорид аммония NH4CI. В результате гидролиза этой соли по катиону повышается кислотность крови:
Повышение кислотности крови, с одной стороны, уменьшает алкалоз, а с другой - мобилизует почки на выделение в мочу ионов натрия, с которыми одновременно выделяется соответствующее количество воды. Выведение аммиака из организма осуществляется через почки в основном в виде мочевины (разд. 23.2).
Наличие у атома азота аммиака неподеленной электронной пары на гибридной sp3-орбитали делает его молекулу активным лигандом, который с катионами металлов жизни Cu2+, Zn2+, Ni2+ образует прочные аммиачные комплексы (разд. 10.3), устойчивость которых соизмерима с прочностью их биокомплексов, что может объяснять токсичность аммиака.
Комплексообразующие свойства аммиака лежат в основе качественного и количественного его определения с помощью реактива Несслера:

 |
Нуклеофильность молекулы аммиака, т. е. ее сродство к атому углерода, несущему частичный положительный заряд, проявляется в способности алкилироваться галоидными алкилами в присутствии оснований. При этом в зависимости от соотношения реагентов образуются различные алкиламины вплоть до получения солей тетраалкиламмония:
Благодаря нуклеофильности молекула аммиака легко аци-лируется, например этилацетатом с образованием ацетамида:

Нуклеофильность азотсодержащих биосубстратов лежит в основе их биохимических превращений при различных реакциях присоединения, замещения, отщепления, протекающих при участии соответствующих ферментов.
Несмотря на низшую степень окисления атома азота (-3), аммиак в условиях организма устойчив к окислению. Его восстановительные свойства проявляются только при высокой температуре, когда происходит горение аммиака в кислороде с образованием азота, а в присутствии платинового катализатора - до оксида азота(Н):

Кислородные соединения азота. Азот образует с кислородом ряд оксидов.
Оксид азота(1) N2O (закись азота) - малополярный, несолеобразующий оксид, который при температуре ниже 500 °С химически малоактивен. Атомы азота в нем не равноценны и имеют разную степень окисления  , Закись азота - бесцветный газ, который в смеси с кислородом используется в медицине для ингаляционного наркоза. При малых концентрациях N2O вызывает возбуждение (отсюда название "веселящий газ"), а при больших - общий наркоз. Один из возможных механизмов действия N2O основан на его гидратации, которая приводит к уменьшению содержания "структурированной" воды в гидратных оболочках биосубстратов и к отслоению последних от внутриклеточной жидкости (см. разд. 11.4).
, Закись азота - бесцветный газ, который в смеси с кислородом используется в медицине для ингаляционного наркоза. При малых концентрациях N2O вызывает возбуждение (отсюда название "веселящий газ"), а при больших - общий наркоз. Один из возможных механизмов действия N2O основан на его гидратации, которая приводит к уменьшению содержания "структурированной" воды в гидратных оболочках биосубстратов и к отслоению последних от внутриклеточной жидкости (см. разд. 11.4).
Оксид азота(Н) N0 - также несолеобразующий оксид. В окислительно-восстановительных реакциях он может быть восстановителем или окислителем, так как его азот имеет промежуточную степень окисления: 
Из-за подвижности 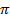 -электронов оксид азота(2) является лигандом, который образует, подобно кислороду, комплексное соединение с катионом железа гемоглобина HHbNO, устойчивость которого в 60 раз больше, чем оксигемоглобина:
-электронов оксид азота(2) является лигандом, который образует, подобно кислороду, комплексное соединение с катионом железа гемоглобина HHbNO, устойчивость которого в 60 раз больше, чем оксигемоглобина:

В этом заключается одна из причин токсичности оксида азота(2). Однако в конце 1980-х годов было установлено, что N0 обязательно синтезируется в организме человека с помощью фермента NO-синтазы из аминокислоты аргинина (разд. 21.2.4). Время жизни N0 в клетках организма составляет порядка секунды, не их нормальное функционирование невозможно без N0. Это простое соединение благодаря высокой химической активности обеспечивает: расслабление гладких мышц сосудов, регуляцию работы сердца, эффективную работу иммунной системы, передачу нервных импульсов, сексуальное возбуждение. Предполагают также, что N0 играет важную роль в обучении и запоминании. За открытие синтеза N0 в организме и исследование его физиологической роли Р. Фурчготт, Л. Игнарро и Ф. Мурад в 1988 г. были удостоены Нобелевской премии.
Оксид азота(3) N2O3 - кислотный оксид, который при растворении в воде образует слабую азотистую кислоту (рКа = 3,29):

 |
Соли азотистой кислоты - нитриты - могут вести себя и как окислители, и как восстановители, в зависимости от свойств партнера:
За счет сильных окислительных свойств нитриты окисляют катион Fe2+ гемоглобина в катион Fe3+ метгемоглобина, а выделяющийся при этом оксид азота(П) образует устойчивый комплекс с гемоглобином - нитрозогемоглобин:
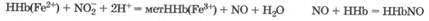
Таким образом, нитриты, попадая в кровь, вызывают метгемоглобинию, острое кислородное голодание тканей из-за уменьшения содержания гемоглобина в крови, а также увеличивают свободнорадикальное окисление в организме.
В желудке нитриты образуют азотистую кислоту, которая при взаимодействии со вторичными аминами образует нитрозоамины - сильные канцерогены:

Следовательно, нитриты являются высокотоксичными веществами, поэтому запрещены добавки нитритов (в качестве консервантов) в мясопродукты.
Оксид азота (IV) NО2 т красно-бурый газ, обладающий характерным запахом. При растворении NO2 в воде образуются азотистая и азотная кислоты:
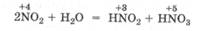
Эта реакция сопровождается межмолекулярной окислительно-восстановительной дисмутацией атомов азота.
В присутствии кислорода образуется только азотная кислота:
4N02 + 2Н20 + 02 = 4HN03
Вдыхание оксида азота(4) в концентрации более 600 мг/м3 приводит к смертельному исходу в результате отека легких (асфиксия). О свойствах NO как загрязнителя атмосферы см. разд. 14.1.
Оксид азота(5) N2O5 - кислотный оксид, при его растворении в воде образуется азотная кислота. HNO3 - сильная кислота, которая в разбавленных растворах полностью диссоциирует на ионы.
В окислительно-восстановительных реакциях азотная кислота - сильный окислитель, причем азот в степени окисления (+5), входящий в состав азотной кислоты, является настолько сильным окислителем в сравнении с катионом водорода, что среди продуктов ее восстановления не образуется молекулярный водород, а есть только продукты восстановления азота (N02, N0, N2O, N2, NH4NO3). Соли азотной кислоты - нитраты -также являются довольно сильными окислителями. Поэтому нитраты, присутствующие в больших количествах в некоторых продуктах питания, попадая в организм, легко восстанавливаются до токсичных нитритов:
 |
В России санитарные нормы регламентируют содержание нитратов в питьевой воде не более 10 мг/л. Высокое содержание нитратов в воде может приводить к заболеванию раком желудка и являться причиной повышенной детской смертности. Свойства оксидов азота и их производных как токсикантов рассмотрены в разд. 14.1.
Дата публикования: 2014-10-16; Прочитано: 3667 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
