 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Водород и его соединения
|
|
Атом водорода по сравнению с атомами других элементов имеет простейшую структуру: он состоит из одного протона.
образующего атомное ядро, и одного электрона, расположенного на ls-орбитали. Уникальность атома водорода заключается в том, что его единственный валентный электрон находится непосредственно в поле действия ядра атома, поскольку он не экранируется другими электронами. Это обеспечивает ему специфические свойства. Он может в химических реакциях отдавать свой электрон, образуя катион Н+ (подобно атомам щелочных металлов), или присоединять электрон от партнера с образованием аниона Н- (подобно атомам галогенов). Поэтому водород в периодической системе помещают чаще в IA группе, иногда в VIIA группе, но встречаются варианты таблиц, где водород не принадлежит ни к одной из групп периодической таблицы.
Молекула водорода двухатомна - Н2. Водород - самый легкий из всех газов. Вследствие неполярности и большой прочности молекулы Н2 (Есв = 436 кДж/моль) при нормальных условиях водород активно взаимодействует только со фтором, а при освещении также с хлором и бромом. При нагревании реагирует со многими неметаллами, хлором, бромом, кислородом, серой, проявляя восстановительные свойства, а вступая во взаимодействие со щелочными и щелочноземельными металлами, является окислителем и образует гидриды этих металлов:

Среди всех органогенов у водорода наименьшая относительная электроотрицательность (0Э0 = 2,1), поэтому в природных соединениях водород всегда проявляет степень окисления +1. С позиции химической термодинамики водород в живых системах, содержащих воду, не может образовывать ни молекулярный водород (Н2), ни гидрид-ион (Н~). Молекулярный водород при обычных условиях химически малоактивен и при этом сильно летуч, из-за чего он не может удерживаться организмом и участвовать в обмене веществ. Гидрид-ион химически чрезвычайно активен и сразу взаимодействует даже с очень малым количеством воды с образованием молекулярного водорода. Поэтому водород в организме находится или в виде соединений с другими органогенами, или в виде катиона Н+.
Водород с элементами-органогенами образует только ковалентные связи. По степени полярности эти связи располагаются в следующий ряд:
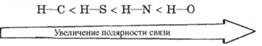 |
Этот ряд очень важен для химии природных соединений, так как полярность этих связей и их поляризуемость предопределяют кислотные свойства соединений, т. е. диссоциацию с образованием протона.
Кислотные свойства. В зависимости от природы элемента, образующего связь Х-Н, выделяют 4 типа кислот:
ОН-кислоты (карбоновые кислоты, фенолы, спирты);
SH-кислоты (тиолы);
NH-кислоты (амиды, имиды, амины);
СН-кислоты (углеводороды и их производные).
С учетом высокой поляризуемости связи S—Н можно составить следующий ряд кислот по способности к диссоциации:

Концентрация катионов водорода в водной среде определяет ее кислотность, которая выражается с помощью водородного показателя рН = -lg[H+] (разд. 7.5). Большинство физиологических сред организма имеет реакцию, близкую к нейтральной (рН = 5,0-7,5), только у желудочного сока рН = 1,0-2,0. Это обеспечивает, с одной стороны, противомикробное действие, убивая многие микроорганизмы, занесенные в желудок с пищей; с другой стороны, кислая среда оказывает каталитическое действие при гидролизе белков, полисахаридов и других биосубстратов, способствуя получению необходимых метаболитов.
Окислительно-восстановительные свойства. Вследствие большой плотности положительного заряда катион водорода является довольно сильным окислителем (ф° = 0 В), окисляя активные и средней активности металлы при взаимодействии с кислотами и водой:

 |
В живых системах таких сильных восстановителей нет, а окислительная способность катионов водорода в нейтральной среде (рН = 7) значительно понижена (ф° = -0,42 В). Поэтому в организме катион водорода не проявляет окислительных свойств, но активно участвует в окислительно-восстановительных реакциях, способствуя превращению исходных веществ в продукты реакции:
Во всех приведенных примерах атомы водорода своей степени окисления +1 не изменили.
Восстановительные свойства характерны для молекулярного и особенно для атомарного водорода, т. е. водорода в момент ныделения непосредственно в реакционной среде, а также для гидрид-иона:

Однако в живых системах таких восстановителей (Н2 или Н-) нет, и поэтому нет подобных реакций. Встречающееся в литературе, в том числе и в учебниках, мнение, что водород является носителем восстановительных свойств органических соединений, не соответствует действительности; так, в живых системах восстановителем биосубстратов выступает восстановленная форма кофермента дегидрогеназы, в которой донором электронов являются атомы углерода, а не атомы водорода (разд. 9.3.3).
Комплексообразующие свойства. Вследствие наличия у катиона водорода свободной атомной орбитали и высокого поляризующего действия самого катиона Н+ он является активным ионом-комплексообразователем. Так, в водной среде катион водорода образует ион гидроксония Н3О+, а при наличии аммиака -ион аммония NH4: 
Склонность к образованию ассоциатов. Атомы водорода сильнополярных связей О—Н и N-—Н образуют водородные связи (разд. 3.1). Прочность водородной связи (от 10 до 100 кДж/моль) зависит от величины локализованных зарядов  и длины водородной связи, т. е. от расстояния между атомами электроотрицательных элементов, участвующих в ее образовании. Для аминокислот, углеводов, белков, нуклеиновых кислот характерны следующие длины водородных связей, пм:
и длины водородной связи, т. е. от расстояния между атомами электроотрицательных элементов, участвующих в ее образовании. Для аминокислот, углеводов, белков, нуклеиновых кислот характерны следующие длины водородных связей, пм:

Благодаря водородным связям возникают обратимые межмолекулярные взаимодействия между субстратом и ферментом, между отдельными группами в природных полимерах, определяющие их вторичную, третичную и четвертичную структуру (разд. 21.4, 23.4). Ведущую роль водородная связь играет в свойствах воды как растворителя и реагента.
Вода и ее свойства. Вода - важнейшее соединение водорода. Все химические реакции в организме протекают только в водной среде, жизнь без воды невозможна. Вода как растворитель рассматривалась в разд. 6.1.
Кислотно-основные свойства. Вода как реагент с позиции кислотно-основных свойств является истинным амфолитом (разд. 8.1). Это проявляется и при гидролизе солей (разд. 8.3.1), и при диссоциации кислот и оснований в водной среде (разд. 8.3.2).
Количественной характеристикой кислотности водных сред является водородный показатель рН.
Вода как кислотно-основной реагент участвует в реакциях гидролиза биосубстратов. Например, гидролиз аденозинтрифосфата служит источником запасенной энергии для организма, ферментативный гидролиз ненужных белков служит для получения аминокислот, являющихся исходным материалом для синтеза необходимых белков. При этом катионы Н+ или анионы ОН- являются кислотно-основными катализаторами реакций гидролиза биосубстратов (разд. 21.4, 23.4).
Окислительно-восстановительные свойства. В молекуле воды и водород, и кислород находятся в устойчивых степенях окисления. Поэтому вода не проявляет ярко выраженных окислительно-восстановительных свойств. Окислительно-восстановительные реакции возможны при взаимодействии воды только с очень активными восстановителями или очень активными окислителями, или в условиях сильной активации реагентов.
Вода может быть окислителем за счет катионов водорода при взаимодействии с сильными восстановителями, например щелочными и щелочноземельными металлами или их гидридами:

При высоких температурах возможно взаимодействие воды с менее активными восстановителями:
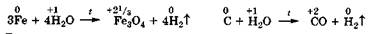
В живых системах их компонент вода никогда не выступает как окислитель, поскольку это привело бы к уничтожению этих систем из-за образования и необратимого удаления молекулярного водорода из организмов.
Вода может выступать в роли восстановителя за счет атомов кислорода  например при взаимодействии с таким сильнейшим окислителем, как фтор:
например при взаимодействии с таким сильнейшим окислителем, как фтор:

Под действием света и при участии хлорофилла в растениях протекает процесс фотосинтеза с образованием О2 из воды (разд. 9.3.6):

Кроме непосредственного участия в окислительно-восстановительных превращениях вода и продукты ее диссоциации Н+ и ОН- принимают участие как среда, которая способствует протеканию многих окислительно-восстановительных реакций вследствие ее высокой полярности ( = 79) и участия образуемых ею ионов в превращениях исходных веществ в конечные (разд. 9.1).
= 79) и участия образуемых ею ионов в превращениях исходных веществ в конечные (разд. 9.1).
Комплексообразующие свойства. Молекула воды из-за наличия у атома кислорода двух неподеленных электронных пар является достаточно активным монодентатным лигандом, который с катионом водорода образует комплексный ион оксония Н30+, а с катионами металлов в водных растворах -достаточно устойчивые аквакомплексы, например [Са(Н20)6]2+, [ Fe(H20)6]3+, [Cu(H20)4]2+. В этих комплексных ионах молекулы ноды ковалентно связаны с комплексообразователями достаточно прочно. Катионы щелочных металлов аквакомплексов не образуют, а за счет электростатических сил образуют гидратированные катионы. Время оседлой жизни молекул воды в гидратных оболочках этих катионов не превышает 0,1 с, а их состав по числу молекул воды может легко изменяться.
Склонность к образованию ассоциатов. Вследствие большой полярности, способствующей электростатическому взаимодействию и образованию водородных связей, молекулы воды даже в чистой воде (разд. 6.1) образуют межмолекулярные ассоциаты, различающиеся по структуре, числу молекул и времени их оседлой жизни в ассоциатах, а также времени жизни самих ассоциатов. Таким образом, чистая вода является открытой сложной динамической системой. Под действием внешних факторов: радиоактивное, ультрафиолетовое и лазерное излучения, упругие волны, температура, давление, электрические, магнитные и электромагнитные поля от искусственных и естественных источников (космос, Солнце, Земля, живые объекты) - вода изменяет свои структурно-информационные свойства, а следовательно, изменяются ее биологические и физиологические функции.
Кроме самоассоциации молекулы воды гидратируют ионы, полярные молекулы и макромолекулы, образуя вокруг них гидратные оболочки, тем самым стабилизируют их в растворе и способствуют их растворению (разд. 6.1). Вещества, молекулы которых неполярны и имеют относительно небольшие размеры, способны только незначительно растворяться в воде, заполняя пустоты ее ассоциатов с определенной структурой. При этом в результате гидрофобного взаимодействия неполярные молекулы структурируют окружающую их гидратную оболочку, превращая ее в структурированный ассоциат, обычно с льдоподобной структурой, внутри которого расположена данная неполярная молекула.
В живых организмах можно выделить две категории воды -"связанную" и "свободную", последняя, по-видимому, есть только в межклеточной жидкости (разд. 6.1). Связанная вода, в свою очередь, подразделяется на "структурированную" (прочносвязанную) и "деструктурированную" (слабосвязанную или рыхлую) воду. Вероятно, все перечисленные выше внешние факторы влияют на состояние воды в организме, изменяя соотношения: "структурированная"/ "деструктурированная" и "связанная"/ "свободная" вода, а также ее структурно-динамические параметры. Это проявляется в изменениях физиологического состояния организма. Не исключено, что внутриклеточная вода непрерывно претерпевает регулируемые, в основном белками, пульсационные переходы из "структурированного" в "деструктурированное" состояние. Эти переходы взаимосвязаны с выталкиванием из клетки отслуживших метаболитов (шлаков) и всасыванием необходимых веществ. С современной точки зрения вода участвует в формировании единой внутриклеточной структуры, благодаря которой достигается упорядоченность процессов жизнедеятельности. Поэтому, по образному выражению А. Сент-Дьёрдьи, вода в организме является "матрицей жизни".
Вода в природе. Вода - самое важное и распространенное вещество на Земле. Поверхность земного шара на 75 % покрыта водой. Объем Мирового океана составляет 1,4 млрд. км3. Столько же воды находится в минералах в виде кристаллизационной воды. Атмосфера содержит 13 тыс. км3 воды. В то же время запасы пресной воды, пригодной для питья и бытовых нужд, довольно ограничены (объем всех пресноводных водоемов составляет 200 тыс. км3). Пресная вода, употребляемая в быту, содержит различные примеси от 0,05 до 1 г/л, чаще всего это соли: гидрокарбонаты, хлориды, сульфаты, - в том числе растворимые соли кальция и магния, присутствие которых делает воду жесткой (разд. 14.3). В настоящее время охрана водных ресурсов и очистка сточных вод являются наиболее актуальными экологическими проблемами.
В обычной воде присутствует около 0,02 % тяжелой воды D2O (D - дейтерий). Она накапливается при испарении или электролизе обычной воды. Тяжелая вода токсична. Тяжелую воду применяют для изучения движения воды в живых организмах. С ее помощью установлено, что скорость движения воды в тканях некоторых растений достигает 14 м/ч, а вода, выпитая человеком, за 2 ч полностью распределяется по его органам и тканям и лишь через две недели полностью выводится из организма. Живые организмы содержат от 50 до 93 % воды, которая является непременным участником всех процессов жизнедеятельности. Без воды жизнь невозможна. При продолжительности жизни 70 лет человек с пищей и питьем потребляет около 70 т воды.
В научной и медицинской практике широко используется дистиллированная вода - бесцветная прозрачная жидкость без запаха и вкуса, рН = 5,2-6,8. Это фармакопейный препарат для приготовления многих лекарственных форм.
Вода для инъекций (апирогенная вода) - также фармакопейный препарат. Эта вода не содержит пирогенных веществ. Пирогены - вещества бактериального происхождения - метаболиты или продукты жизнедеятельности бактерий, которые, попадая в организм, вызывают озноб, повышение температуры тела, головные боли, нарушение сердечно-сосудистой деятельности. Приготавливают апирогенную воду двойной перегонкой ноды (бидистиллят) с соблюдением асептических условий и используют в течение 24 ч.
Заканчивая раздел, необходимо подчеркнуть особенности водорода как биогенного элемента. В живых системах водород всегда проявляет степень окисления +1 и встречается или связанным полярной ковалентной связью с другими биогенными элементами, или в виде катиона Н+. Катион водорода является носителем кислотных свойств и активным комплексообразователем, взаимодействующим со свободными электронными парами атомов других органогенов. С позиции окислительно-восстановительных свойств связанный водород в условиях организма не проявляет свойств ни окислителя, ни восстановителя, однако катион водорода активно участвует во многих окислительно-восстановительных реакциях, не изменяя при этом своей степени окисления, но способствуя превращению биосубстратов в продукты реакции. Водород, связанный с электроотрицательными элементами, образует водородные связи.
Дата публикования: 2014-10-16; Прочитано: 6836 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
