 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Структура и свойства белков
|
|
Белки, или протеины, в живых организмах образуются в основном из 20 важнейших природных ос-аминокислот в результате реакции поликонденсации в присутствии ферментов. Молекулярные массы белков варьируют в очень широких пределах: от 10 000 до 1 000 000 и выше.
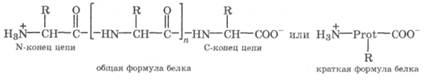
Остов белковой цепи построен из аминокислотных фрагментов, соединенных пептидной связью, и окружен разнообразными по химической природе заместителями. Пептидная связь в белках устойчива при 37°С в нейтральной среде, но в кислой или щелочной среде может гидролизоваться. В организме гидролиз белка осуществляется под действием ферментов пептидаз и строго контролируется.
В природных белках широко варьируются длина и состав цепи, что позволяет их молекулам даже в растворе принимать многообразные конформации.
Конформации макромолекулы белка в растворе представляют собой различные ее пространственные формы, возникающие в результате поворотов отдельных молекулярных фрагментов вокруг ординарных связей и стабилизирующиеся за счет межмолекулярных связей между отдельными группами данной макромолекулы или молекулами веществ, находящимися в окружающем растворе.
Взаимные переходы конформации в основном осуществляются без разрыва ковалентных связей в макромолекуле белка. При описании состава и конформации белка используют понятия первичная, вторичная, третичная и четвертичная структуры.
Первичная структура специфична для индивидуального белка и определяется составом и последовательностью аминокислотных остатков его цепи. При написании полных формул белков указывают порядок следования друг за другом аминокислотных остатков с помощью их трехбуквенных обозначений, начиная с N-конца цепи. Представление о первичной структуре миоглоби-на человека, содержащего в молекуле всего 153 аминокислотных остатка, дает следующая сокращенная запись:
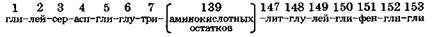
Строго линейное расположение полипептидной цепи энергетически не выгодно, так как оно практически исключает взаимодействия между различными радикалами аминокислотных остатков. В результате именно таких взаимодействий возникают дополнительные связи, которые стабилизируют ту или иную конформацию белковой цепи в пространстве. Это происходит за счет следующих взаимодействий: ион-ионного взаимодействия; водородной связи; гидратации полярных групп; дисульфидной связи; взаимодействий Вандер-Ваальса между неполярными заместителями; гидрофобных взаимодействий, в результате которых выталкиваются молекулы воды из зоны взаимодействия неполярных заместителей между собой, а также донорно-акцепторной связи между ионом комплексообразователя и лигандными группами белка (рис. 21.3).
Вторичная структура белка характеризует форму полипептидной цепи, которая может быть спиралевидной (а-структура), складчатой (B -структура) или неупорядоченной (рис. 21.4). Основную роль в формировании и поддержании вторичной структуры
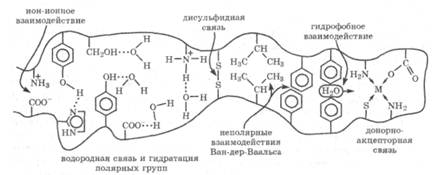
Рис. 21.3. Типы взаимодействий между заместителями аминокислотных остатков белковой молекулы и водной средой
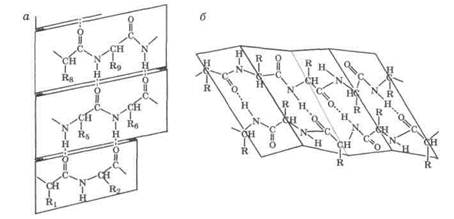 |
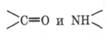 Рис. 21.4. Вторичная структура белков: а - а-структура (спиралевидная), б - Р-структура (складчатая) играют водородные связи, возникающие между группами хребта полипептидной цепи.
Рис. 21.4. Вторичная структура белков: а - а-структура (спиралевидная), б - Р-структура (складчатая) играют водородные связи, возникающие между группами хребта полипептидной цепи.
Пространственное расположение а-структуры можно представить, вообразив, что полипептидная цепь обвивает цилиндр, а ее боковые радикалы направлены наружу. Витки спирали скреплены между собой за счет водородных связей между пептидными группами, расположенными на соседних витках спирали. И хотя энергия этих связей невелика, большое их число приводит к значительному энергетическому эффекту, в результате чего a-структура достаточно устойчива и жестка.
Складчатая (3-структура формируется из большого числа параллельных вытянутых полипептидных цепей, связанных множеством водородных связей между собой. Боковые радикалы R располагаются выше и ниже плоскости, проведенной через образовавшийся складчатый лист.
Неупорядоченная структура отдельных фрагментов белка характеризуется отсутствием пространственной упорядоченности в их расположении.
Какая вторичная структура белка реализуется - зависит от его аминокислотного состава, т. е. от первичной структуры. Для большинства природных белков характерно сосуществование в одной молекуле фрагментов с а-, р- и неупорядоченной структурой.
Невысокая прочность водородных связей позволяет сравнительно легко трансформировать вторичную структуру под внешним воздействием: изменением температуры, состава или рН среды - или под механическим воздействием. В результате трансформации вторичной структуры белка меняются его нативные, т. е. первичные от природы, свойства, а следовательно, его биологические и физиологические функции.
Третичная структура белка определяет общее расположение его полипептидной цепи в пространстве. Полагают, что в формировании и стабилизации третичной структуры белковой молекулы решающая роль принадлежит взаимодействию боковых заместителей аминокислот, которые сближаются в пространстве за счет изгибов полипептидной цепи. Виды этих взаимодействий были показаны на рис. 21.3.
Третичная структура белковой молекулы возникает совершенно автоматически в результате самоорганизации полипептидной цепи в соответствии с ее первичной и вторичной структурами, а также с составом окружающего раствора. Движущей силой, свертывающей полипептидную цепь белка в строго определенное трехмерное образование, является взаимодействие аминокислотных радикалов между собой и с молекулами окружающего раствора. При этом в водных растворах гидрофобные заместители •вталкиваются внутрь белковой молекулы, образуя там сухие зоны ("жирные капли"), а гидрофильные - ориентируются в сторону водной среды. В некоторый момент достигается энергетически выгодная конформация молекулы для водной среды, и такая конформация белковой молекулы стабилизируется. При этом энтропия полипептидной цепи уменьшается, а энтропия системы в целом (полипептидная цепь + водная среда) остается постоянной или возрастает. Таким образом, с позиции II закона термодинамики стабилизацию третичной структуры белка в водной среде обеспечивает стремление водного окружения молекулы белка перейти в состояние с максимальной энтропией. Представление о третичной структуре молекул белков миоглобина и лизоцима дает рис. 21.5. На рисунке заштрихованный диск в молекуле миоглобина - это гем, содержащий порфириновый лиганд и комплексообразователь катион Fe2+. В молекуле лизоцима показаны S—S дисульфидные мостики, участвующие в стабилизации третичной структуры этого белка.
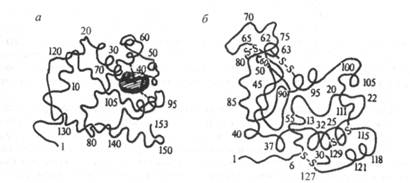
Рис. 21.5. Третичные структуры: миоглобина (а) и лизоцима (б)
Третичная структура белка, по сравнению с его вторичной структурой, еще более чувствительна к внешним воздействиям. Поэтому действие слабых окислителей, смена растворителей, изменения ионной силы, рН среды и температуры нарушают третичную структуру белков, а следовательно, и их нативные свойства.
Четвертичная структура. Крупные молекулы белка с молекулярной массой более 60 000 обычно представляют собой агрегаты, которые состоят из нескольких полипептидных цепей со сравнительно небольшой молекулярной массой. При этом каждая цепь, сохраняя характерную для нее первичную, вторичную и третичную структуру, выступает в роли субъединицы этого агрегата, имеющего более высокий уровень пространственной организации - четвертичную структуру. Такая молекулаагрегат представляет единое целое и выполняет биологическую функцию, не свойственную отдельно взятым субъединицам. Например, молекула гемоглобина состоит из 4 субъединиц и для нее характерна значительно большая лабильность комплекса с кислородом, чем для отдельных ее субъединиц, что проявляется в свойствах миоглобина (разд. 10.4). Четвертичная структура белка закрепляется в основном за счет водородных связей и вандерваальсовых взаимодействий, а иногда и дисульфидных связей между объединяемыми полипептидными цепями. Молекулярная масса белков с четвертичной структурой может достигать нескольких десятков миллионов. Четвертичная структура белков чувствительна к внешним воздействиям и может ими нарушаться.
Форма белковых молекул. По форме молекулы нативные белки, т. е. проявляющие запрограммированные природой биологические свойства, делят на фибриллярные и глобулярные. Молекулы фибриллярных белков обычно имеют B-структуру и волокнистое строение; они не растворяются в воде, так как на их поверхности много гидрофобных радикалов. Фибриллярными белками являются фиброны белка; кератин волос, кожи, ногтей; коллаген сухожилий и костной ткани; миозин мышечной ткани.
Глобулярные белки имеют цилиндрическую или сферическую форму и размер 10-9-10-7 м. Они обычно растворяются в воде, так как на их поверхности в основном находятся полярные группы. Растворяясь в воде, глобулярные белки образуют лиофильные коллоидные растворы (разд. 27.3). Примеры глобулярных белков: альбумин (яичный белок), миоглобин, почти все ферменты.
Жидкокристаллическое состояние. Молекулы белков - достаточно крупные образования и имеют фиксированную пространственную структуру, которая может быть анизотропна в целом, или могут быть анизотропны отдельные фрагменты пептидной цепи. Поэтому для многих белков характерно жидкокристаллическое состояние в определенном температурном интервале (термотропное жидкокристаллическое состояние) или образование одного или нескольких лиотропных жидкокристаллических со стояний с участием водной среды при определенной концентрации веществ в растворе. Образование жидкокристаллического состояния или переходы из одного жидкокристаллического состояния в другое, сопровождаемые изменением ориентации отдельных фрагментов молекулы белка или изменением в согласованности движения в системе, не требуют больших энергетических затрат, но могут привести к изменению его биологических функций. Например, повлиять на сократительную функцию миозина мышечных волокон, ферментативную активность, транспортную функцию белков или их защитные свойства относительно коллоидных систем. Так, при определенных условиях молекулы гемоглобина переходят в жидкокристаллическое состояние. Это приводит к ряду патологических нарушений, проявляющихся в потере эластичности эритроцитами. В результате они закупоривают капилляры, и транспорт кислорода нарушается. Образование камней в моче- или желчевыводящих системах связано с изменением не только концентрации, но и состояния защитных белков в этих системах. Способность белков и их растворов переходить в жидкокристаллическое состояние до последнего времени в биологии, биохимии и медицине практически не рассматривалась, несмотря на чрезвычайную важность этих свойств с позиции жизнедеятельности любых живых систем.
Денатурация. Пространственная структура белков, как уже указывалось, может нарушаться под влиянием ряда факторов: повышение температуры, изменение рН и ионной силы среды, облучение УФ и рентгеновскими лучами, присутствие веществ, способных дегидратировать молекулу белка (этанол, ацетон, мочевина) или вступать во взаимодействие с его заместителями (окислители, восстановители, формальдегид, фенол) и даже при сильном механическом перемешивании растворов.
Денатурацией называется разрушение природной (нативной) конформации макромолекулы белка под внешним воздействием.
При денатурации разрушаются четвертичная, третичная и вторичная структуры, а первичная структура белка сохраняется. Поэтому денатурация может иметь обратимый (денатурация -ренатурация) и необратимый характер в зависимости от природы белка и интенсивности внешнего воздействия. Необратимая денатурация обычно происходит при тепловом воздействии (например, свертывание яичного альбумина при варке яиц). У денатурированных глобулярных белков уменьшается сродство к воде, так как на поверхности молекул оказывается много гидрофобных радикалов. Поэтому снижается их растворимость, появляются хлопья или осадок. Главное, при денатурации утрачивается биологическая активность и глобулярных, и фибриллярных белков, что наблюдается при многих способах их выделения (разд. 11.3). Во избежание денатурации белка и для сохранения его нативной конформации в процессе выделния все операции проводят в мягких условиях при температуре не выше 5°С, избегая резких воздействий химических реагентов.
Поверхностные свойства белков. Молекулы белков содержат разные ос-аминокислоты, имеющие и гидрофобные радикалы на основе алифатических и ароматических углеводородов, и гидрофильные радикалы, включая пептидную группировку. Эти радикалы распределены по всей цепи, и поэтому большинство белков является поверхностно-активными веществами (разд. 26.6). Характерная особенность белковых ПАВ - наличие в их молекулах фрагментов с резко различным гидрофильно-липофильным балансом, что делает их эффективными стабилизаторами для лиофобных дисперсных систем, эмульгаторами жиров и холестерина и активными компонентами биологических мембран.
Благодаря поверхностно-активным свойствам некоторые белки образуют лиофильные мицеллы (разд. 27.3) с липидами (включая холестерин и его эфиры), называемые липопротеинами. В липопротеинах между молекулами белков и липидов нет ковалентных связей, а есть только межмолекулярные взаимодействия. Внешняя поверхность липопротеиновой мицеллы состоит из гидрофильных фрагментов белков и молекул фосфо-липидов, а ее внутренняя часть (ядро) представляет собой гидрофобную среду, в которой растворены жиры, холестерин и его эфиры (рис. 21.6). Наличие в липопротеинах внешней гидрофильной оболочки делает эти богатые липидами мицеллы "растворимыми" в воде и хорошо приспособленными для транспорта жиров из тонкого кишечника в жировые депо и в различные ткани. Диаметр липопротеиновых мицелл составляет от 7 до 1000 нм.
В зависимости от плотности, размеров мицелл и соотношения в них белка и липидов липопротеины подразделяют на 4 класса (табл. 21.2).
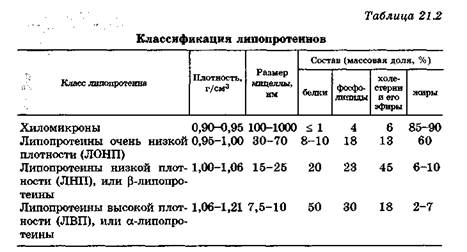 |
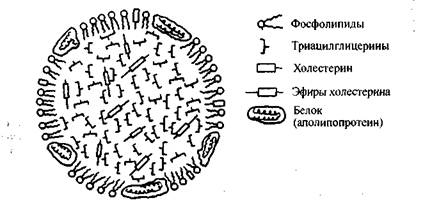
Рис. 21.6. Мицелла липопротеина
Роль хиломикронов и липопротеинов очень низкой плотности заключается в транспорте жиров и их гидролизе под действием липопротеинлипазы. По мере расщепления жиров происходит превращение:
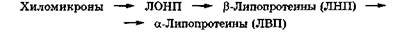
Р-Липопротеины в основном транспортируют холестерин в клетки, а а-липопротеины выводят из клеток избыток холестерина.
При изучении липопротеинового состава сыворотки крови установлено, что чем больше отношение B-липопротеины/а-липо-протеины, тем больше опасность обильных отложений холестерина на внутренней поверхности кровеносных сосудов, т. е. атеросклероза. Атеросклероз способствует развитию инсульта или инфаркта миокарда за счет ограничения кровотока через суженные сосуды мозга или сердца.
Поверхностные свойства белков, характеризующие их способность к межмолекулярным взаимодействиям, лежат в основе взаимодействия фермента с субстратом (разд. 5.6), антитела с антигеном и объясняют различные взаимодействия, называемые в биологии специфической комплементарностью (теория "ключа и замка"). Во всех этих случаях имеет место строгое соответствие между поверхностной структурой и свойствами взаимодействующих частиц, которые обеспечивают высокую эффективность различных видов межмолекулярных взаимодействий между ними (рис. 21.3). В биологии это часто упрощенно отражают, используя графическое соответствие форм и размеров взаимодействующих частиц (рис. 21.7).
Информационные свойства белков. Молекулы белков и отдельные их фрагменты рассматриваются как носители биологической
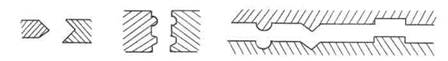
Рис. 21.7. Графическая интерпретация соответствия межмолекулярных взаимодействий между белковыми частицами, описываемых специфической комплементарностью или теорией "ключа и замка"
информации, в которой роль букв алфавита играют 20 аминокислотных остатков. В основе считывания этой информации находятся различные виды межмолекулярных взаимодействий и стремление системы использовать их эффективно. Например, в ферментах вблизи активного центра часть белковой молекулы содержит определенные аминокислотные остатки, заместители которых сориентированы в пространстве так, чтобы происходило узнавание строго определенного субстрата, с которым реагирует данный фермент. Аналогично протекает взаимодействие антитело - антиген или происходит синтез в организме соответствующего антитела на появившийся антиген. Информационные свойства белков лежат в основе иммунитета, представляющего собой целостную систему биологических механизмов самозащиты организма, в основе которых лежат информационные процессы распознавания "свой" и "чужой". "Аминокислотный язык", содержащий 20 единиц, является одним из наиболее оптимальных и надежных способов кодирования важной информации для жизнедеятельности живых систем, включающей сведения о форме отдельных органов и организма в целом.
Кислотно-основные свойства. Белки, как и а-аминокислоты (разд. 8.2), являются полиамфолитами, проявляя кислотные свойства за счет неионизованных карбоксильных групп —СООН, аммонийных групп 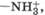 тиольных групп —SH, а также n-гидрокси-
тиольных групп —SH, а также n-гидрокси-
фенильных групп 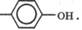 Основные свойства белки проявляют за счет групп — СОО-, аминогрупп — NH2, а также заместителей имидазола —C3H3N2 и гуанидина —(CH5N3)+. В водных растворах в зависимости от рН среды белки могут находиться при рН = рI белка в молекулярной, т. е. нейтральной форме, имеющей биполярно-ионное строение, при рН < рI белка появляется катионная форма, и при рН > рI белка появляется анионная форма, в основном за счет ионизации заместителей (—RH).
Основные свойства белки проявляют за счет групп — СОО-, аминогрупп — NH2, а также заместителей имидазола —C3H3N2 и гуанидина —(CH5N3)+. В водных растворах в зависимости от рН среды белки могут находиться при рН = рI белка в молекулярной, т. е. нейтральной форме, имеющей биполярно-ионное строение, при рН < рI белка появляется катионная форма, и при рН > рI белка появляется анионная форма, в основном за счет ионизации заместителей (—RH).
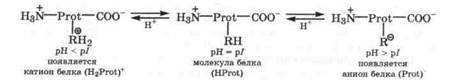
В сильнокислой среде происходит протонирование ионизованной карбоксильной группы белка, а в сильнощелочной среде - депротонирование концевой аммонийной группы. Однако в биологических средах, для которых не характерны такие крайние значения рН, подобных превращений с белковыми молекулами не происходит. Кислотно-основные превращения в молекулах белков, естественно, сопровождаются изменением их конформации, а следовательно, биологические и физиологические функции катиона или аниона белков будут отличаться не только друг от друга, но и от функций их молекул.
В зависимости от аминокислотного состава белки подразделяются на "нейтральные" (рI = 5,0 - 7,0), "кислотные" (рI < 4,0) и "основные", или "щелочные" (рI > 7,5) (табл. 21.3). В кислотных белках повышенное содержание аспарагиновой или глутаминовой кислот, а в "основных" - аргинина, лизина или гистидина. На основе белков в организме действуют белковые буферные системы (разд. 8.4).
Различие в кислотно-основных свойствах белков лежит в основе разделения и анализа белковых смесей методами электрофореза и ионообменной хроматографии. В постоянном электрическом поле белки обладают электрофоретической подвижностью, причем направление их движения к катоду или аноду зависит от значения рН раствора и рI белка. При рН < рI белок частично находится в форме катиона и перемещается к катоду. При рН > рI белок перемещается к аноду, поскольку частично находится в форме аниона. При рН = рI белок полностью находится в молекулярной форме и под действием электрического поля не перемещается. Электрофо-ретическая подвижность иона белка зависит от его размера и заряда, а также от рН раствора. Подвижность иона будет тем больше, чем больше разница между рН раствора и рI белка. Анализ белка с помощью электрофореза широко применяется в клинической биохимии для диагностики заболеваний.
Комплексообразующие свойства. Белки — активные полидентатные лиганды (разд. 10.1), особенно содержащие мягкие функциональные группы: тиольную, имидазольную, гуанидиновую, аминогруппу:
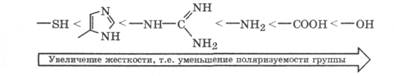
Вследствие наличия в молекулах белков различных функциональных групп они образуют комплексные соединения разной устойчивости в зависимости от поляризуемости иона комплексо-образователя. С малополяризуемыми (жесткими) катионами К+ и Na+ белки образуют малоустойчивые комплексы, которые в организме выполняют роль ионофоров для катионов или активаторов белков как субстратов для тех или иных биохимических процессов. С менее жесткими катионами Mg2+ или Са2+ белки образуют достаточно прочные комплексы. С катионами d-металлов: железа, меди, марганца, цинка, кобальта, молибдена ("металлы жизни"), достаточно поляризуемыми, т. е. мягкими, белки образуют прочные комплексы. Однако особенно прочные комплексы они образуют с катионами металлов-токсикантов: свинца, кадмия, ртути и другими, проявляющими высокую поляризуемость, т. е. очень мягкими. Прочные комплексы белков с катионами металлов часто называют металлопротеинами.
Множество ферментов представляют собой хелатные комплексы белка с катионом какого -либо "металла жизни". При этом именно катион комплексообразователя под влиянием белкалиганда является активным центром фермента, а фрагмент белковой молекулы вблизи этого центра обычно выполняет роль опо-знавателя и активатора субстрата. Белковый компонент метал-лофермента часто называют апоферментом.
Все белки при обработке солями меди в щелочной среде образуют хелатный комплекс фиолетового цвета, что является качественной реакцией на белки, которая называется биуретовой реакцией:
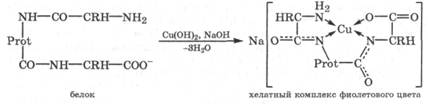
Эта реакция происходит путем депротонирования пептидных групп белка, чему способствуют щелочная среда и наличие в ней иона комплексообразователя.
Электрофильно-нуклеофильные реакции. К этим реакциям прежде всего относится гидролиз белков — основной путь их катаболизма (распада) в организме. При гидролизе белка реагент -молекула воды - выступает и как нуклеофил за счет ОН", и как электрофил за счет Н+. Нуклеофильная частица ОН" атакует электрофильный центр пептидной связи, т. е. углеродный атом карбонильной группы, а нуклеофильный центр этой связи - атом азота - атакуется электрофилом - протоном. В результате атаки молекулами воды пептидные связи в белках разрываются, и образуются вначале осаминокислоты и пептиды, а конечными продуктами являются ос-аминокислоты.
Гидролитический распад белков протекает в любой клетке организма, точнее, в ее липосомах, где сосредоточены гидролитические ферменты. Гидролиз белков может быть частичным (до пептидов) и полным (до аминокислот). Частичный гидролиз ускоряется протеиназами, которые способствуют образованию пептидов. Полученные пептиды гидролизуются до аминокислот при участии пептидаз. В организме гидролиз белков осуществляется в основном целым набором ферментов, каждый из которых расщепляет ту пептидную связь, которая образована определенными аминокислотами. Так, карбоксипептидаза специфически отщепляет от белков С-концевую аминокислоту, трипсин гидролизует пептидную связь между аминокислотами с неполярным (гидрофобным) заместителем. Химотрипсин расщепляет пептидную связь, образованную фенилал анином, тирозином, триптофаном с другими аминокислотами. В организме пищевые белки расщепляются полностью, поскольку для жизнедеятельности используются в основном свободные ос-аминокислоты.
В лабораторных условиях белки гидролизуются как в кислой, так и в щелочной среде. Однако щелочной гидролиз практически не используется из-за неустойчивости многих осаминокислот в этих условиях. Обычно полный гидролиз проводят при нагревании белка до 110°С в запаянной ампуле с 20 % НС1 в течение 24 ч. В этих условиях гидролиз белка протекает до конца, но образующийся триптофан при этом полностью разлагается. Поэтому предпочтение отдают ферментативному гидролизу.
Белки организма, содержащие аспарагиновую и глутамино-вую кислоты, могут выступать акцептором аммиака, который как нуклеофил реагирует по свободным карбоксильным группам заместителя, т. е. происходит реакция амидирования белков:

Реакция амидирования - эндэргоническая, поэтому в организме она сопряжена с реакцией гидролиза АТФ.
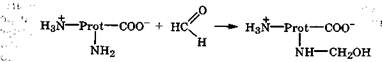 |
С целью стерилизации объектов (полного освобождения от микроорганизмов) их обрабатывают формальдегидом. Формальдегид как активный электрофил реагирует по свободным аминогруппам белков, образуя их метилольные производные:
В результате этой реакции белок теряет свои нативные свойства, так как происходит его необратимая денатурация.
Активные электрофильные реагенты (ЕХ): 2,4-динитрофтор-бензол, фенилизотиоцианат или дансилхлорид - используются для установления первичной структуры белков или пептидов. Они в присутствии оснований реагируют по N-концевой аминокислоте аниона белка и способствуют ее отщеплению в виде соответствующего производного Е—NH—CRH—СООН, легко идентифицируемого или хроматографически, или спектрально:
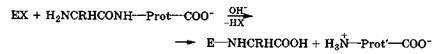
Оставшаяся часть белка  при этом не разрушается, а операции по отщеплению следующей аминокислоты можно повторять. Эти реакции лежат в основе работы автоматического анализатора первичной структуры белков. Обычно анализируемый белок вначале подвергают частичному гидролизу с получением нескольких пептидов. Полученные пептиды разделяют, очищают, и в каждом определяется последовательность аминокислот, а затем составляется первичная структура анализируемого белка.
при этом не разрушается, а операции по отщеплению следующей аминокислоты можно повторять. Эти реакции лежат в основе работы автоматического анализатора первичной структуры белков. Обычно анализируемый белок вначале подвергают частичному гидролизу с получением нескольких пептидов. Полученные пептиды разделяют, очищают, и в каждом определяется последовательность аминокислот, а затем составляется первичная структура анализируемого белка.
Окислительно-восстановительные свойства. Белки относительно устойчивы к мягкому окислению, за исключением содержащих аминокислоту цистеин, так как тиольная группа последней легко окисляется в дисульфидную группу, причем процесс может носить обратимый характер:

В результате этих превращений происходит изменение конформации белка и его нативных свойств. Поэтому серосодержащие белки чувствительны к свободнорадикальному окислению или восстановлению, что происходит при воздействии на организм радиации или токсичных форм кислорода (разд. 9.3.9).
Тиол-дисульфидные превращения белка кератина лежат в основе химической завивки волос, так как цистеин и цистин входят в его состав. Сначала волосы обрабатывают восстановителем, чтобы разрушить связи —S—S— цистина и превратить в тиольные группы цистеина. Затем волосы укладывают в локоны (завивают) и обрабатывают окислителем. При этом образуются дисульфидные связи цистина, которые помогают волосам сохранить их новую форму.
При более жестком окислении тиольная группа белков окисляется в сульфогруппу практически необратимо:
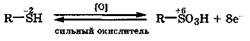
Жесткое окисление белков до СО2, H2O и аммонийных солей используется организмом для устранения ненужных белков и пополнения своих энергетических ресурсов (16,5 - 17,2 кДж/г).
В организме белки, содержащие остатки лизина, пролина, фе-нилаланина и триптофана, подвергаются ферментативному гидроксилированию (монооксигеназное окисление) при участии кислорода и восстановленной формы кофермента:
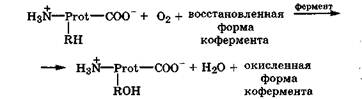
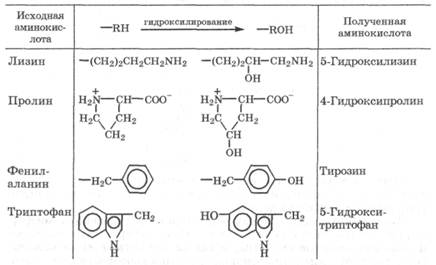
В результате реакции гидроксилирования усиливаются гидрофильные свойства белка и его способность к образованию водородных связей. Это имеет место у тропоколлагена, у которого три цепи объединяются в устойчивую суперспираль за счет водородных связей, в образовании которых участвуют и гидроксипролиновые остатки.
Лизинсодержащие белки способны к ферментативному окислительному дезаминированию. В результате в заместителе вместо аминогруппы появляется альдегидная. Это повышает склонность нового белка к реакциям конденсации с образованием новых ковалентных связей.
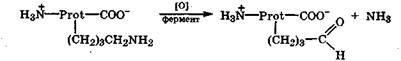
Подобная реакция происходит в молекуле тропоколлагена, что приводит к еще более прочной "сшивке" его пептидных цепей.
Окислительное дезаминирование белков под действием нингидрина, сопровождаемое образованием синего окрашивания, -характерная качественная реакция на белки - нингидриновая реакция (см. разд. 21.2.4).
Для обнаружения белков, содержащих ароматические и гетероциклические аминокислоты, используется ксантопротеиновая реакция, которая при действии концентрированной азотной кислоты сопровождается появлением желтого окрашивания, переходящего при добавлении щелочи или аммиака в оранжевое:
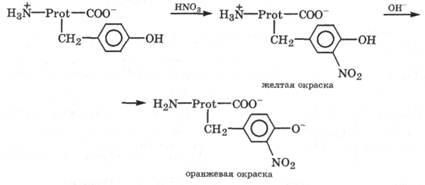
Именно в результате ксантопротеиновой реакции наблюдается желтое окрашивание кожи при попадании на нее концентрированной азотной кислоты.
Таким образом, для белков характерны: определенная конформация, жидкокристаллическое состояние, поверхностно-активные и информационные свойства, а также все четыре вида химических реакций: кислотно-основные, комплексообразующие, электрофильно-нуклеофильные и окислительно-восстановительные, лежащие в основе жизнедеятельности любых живых систем. Совокупность всех этих свойств объясняет уникальность белков для всего живого мира.
 |
Дата публикования: 2014-10-16; Прочитано: 8066 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
