 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Строение, изомерия и свойства моносахаридов
|
|
Моносахариды - твердые вещества, легко растворимые в воде, их растворы имеют нейтральную среду. Большинство моносахаридов обладает сладким вкусом. По числу углеродных атомов в молекуле моносахариды (монозы) подразделяются на тетрозы (С4), пентозы (С5), гексозы (С6) и т. д. Окончание -оза указывает на принадлежность вещества к классу углеводов. Моносахариды являются гетерофункциональными соединениями: они содержат несколько гидроксильных групп и карбонильную группу, поэтому для них характерны разнообразные виды изомерии.
Структурная изомерия (изомерия характера функциональной группы) моносахаридов заключается в том, что их карбонильная группа может входить в альдегидную, кетогруппу или участвовать в образовании циклических таутомеров. Цепные таутомеры моносахаридов являются или полигидроксиальдегидами (аль-дозами), или полигидроксикетонами (кетозами).

Особенности таутомерии моносахаридов будут рассмотрены после знакомства с их пространственной изомерией.
Пространственные изомеры моносахаридов, называемые диастереомерами, различаются взаимным расположением гидроксильных групп и атомов водорода в пространстве, а также физическими и химическими свойствами. Каждый диастерео-мер имеет свое тривиальное название. Среди альдопентоз наибольшее значение имеют диастереомеры рибоза и ксилоза:
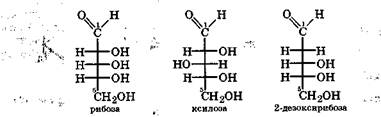
При гидролизе дезоксирибонуклеиновой кислоты образуется 2-дезоксирибоза - производное рибозы, у которого нет гидро-ксильной группы при 2-м углеродном атоме.
Альдогексозы в организме в основном представлены диастереомерами глюкозой, маннозой, галактозой, а кетогексозы - фруктозой:
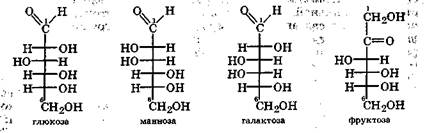
Каждый диастереомер может существовать в виде двух оптических изомеров, называемых D- и L-энантиомерами. В отличие от природных а-аминокислот, существующих в L-форме, природные углеводы обычно существуют в D-форме.
Кольчато-цепная таутомерия. Все перечисленные природные моносахариды, являясь многоатомными спиртами, содержащими карбонильную группу, легко вступают за счет ОН-групп у С-4 или С-5 в обратимую внутримолекулярную реакцию присоединения по карбонильной группе. В результате этой реакции из нециклического таутомера образуются термодинамически более устойчивые пяти- и шестичленные циклические таутомеры данного моносахарида. Пятичленные циклические таутомеры называются фуранозами, а шестичленные - пиранозами.
Эти термины, указывающие на размер цикла, используют в названиях циклических таутомеров моносахаридов. Например, пяти- и шестичленные циклические таутомеры глюкозы называются глюкофураноза и глюкопираноза соответственно. Для наглядного условного изображения циклических таутомеров используют графические формулы, предложенные Хеуорсом:

Нумерацию углеродных атомов в циклических таутомерах ведут по часовой стрелке, сохраняя нумерацию нециклического тау-томера. Заместители в циклических таутомерах помещают выше или ниже плоскости цикла в зависимости от их расположения в молекуле. В циклических таутомерах моносахаридов нет карбонильной группы, и по своей структуре они относятся к циклическим полуацеталям. Атом углерода С-1, ранее входивший в состав карбонильной группы, в циклическом таутомере называют аномерным, а связанную с ним гидроксильную группу - полуацетальной или гликозидной. В зависимости от пространственного расположения этой гидроксильной группы у циклических тауто-меров различают два стереоизомера - а и Р, называемых а- и B- аномерами (частный случай диастереомеров). У природных моносахаридов в a-аномерах гликозидная гидроксильная группа расположена под плоскостью цикла, а в Р-аномерах - над плоскостью. Таким образом, у гексоз возможны следующие таутомеры:

Теоретически у каждой пентозы или гексозы в растворе может быть пять таутомеров, находящихся в равновесии. При этом взаимные переходы циклических таутомеров совершаются только через нециклический таутомер. Несмотря на это, он обычно присутствует в равновесной смеси в следовых количествах. Положение таутомерного равновесия зависит от природы моносахарида, его агрегатного состояния и природы растворителя.
В кристаллическом состоянии моносахариды можно получить только в виде одного циклического таутомера, или a-аномера, или Р-аномера в зависимости от природы растворителя, который использован для кристаллизации. Так, кристаллическая глюкоза, полученная перекристаллизацией из спирта, содержит только а-глюкопиранозу, а если ее перекристаллизовы-вать из пиридина, то образуется B-глюкопираноза.
При растворении моносахарида в воде образуется равновесная смесь различных таутомеров. У природных моносахаридов нециклический таутомер в водных растворах присутствует в следовых количествах, в основном они находятся в виде циклических таутомеров, причем преобладают таутомеры-пиранозы с шестичленным кольцом, которые термодинамически более устойчивы (табл. 22.1).
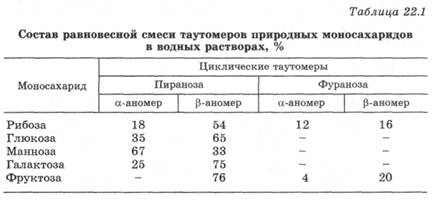
Поскольку моносахариды существуют в виде равновесной смеси нециклических и циклических таутомеров, они проявляют свойства многоатомных спиртов, альдегидов или кетонов и их полуацеталей. В зависимости от условий и реагента моносахарид может проявлять свойства любого таутомера, даже того, содержание которого в смеси незначительно. Это объясняется возможностью пополнения количества этого таутомера по мере его расходования за счет других таутомеров, находящихся с ним в равновесии. Так, в водных растворах альдогексозы дают реакции, характерные для альдегидной группы, хотя нециклический таутомер, содержащий альдегидную группу, в таутомерной смеси присутствует в следовых количествах.
Конформационная изомерия характерна для циклических таутомеров моносахаридов. Данные рентгеноструктурных исследований кристаллических альдоз показали, что пиранозы существуют в виде кресловидной конформации, причем такой, в которой наибольшее число объемных заместителей расположено экваториально (разд. 15.2). Для фуранозных таутомеров наиболее устойчивая конформация - конверт.
Оптическая изомерия моносахаридов обусловлена наличием в их молекулах нескольких хиральных атомов углерода. Оптические, или зеркальные, изомеры называют энантиомерами. Энан-тиомеры имеют идентичные физические и химические свойства и характеризуются одинаковыми по значению, но противополож  ными по знаку углами
ными по знаку углами 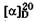 вращения плоскости поляризации света. Величину и знак (+ или -) угла оптического вращения определяют только экспериментально с помощью поляриметра*. Эти показатели нельзя предсказать исходя из молекулярной структуры соединения. Каждый диастереомер моносахарида, как нециклический, так и циклический, имеет два энантиомера: левовращающий (-) и правовращающий (+).
вращения плоскости поляризации света. Величину и знак (+ или -) угла оптического вращения определяют только экспериментально с помощью поляриметра*. Эти показатели нельзя предсказать исходя из молекулярной структуры соединения. Каждый диастереомер моносахарида, как нециклический, так и циклический, имеет два энантиомера: левовращающий (-) и правовращающий (+).
В то же время энантиомеры отличают один от другого, относя их к D- или L-ряду, путем сравнения расположения заместителей (Н и ОН) у их предпоследнего (n-1) углеродного атома с расположением соответствующих заместителей у D- и L-энантиомеров глицеринового альдегида, являющегося конфигурационным стандартом.
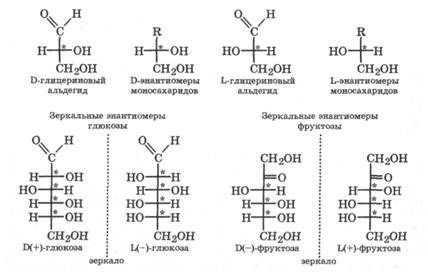
Подавляющее большинство природных моносахаридов принадлежит к D-ряду, однако среди них имеются как лево- (-), так и правовращающие (+) соединения. Так, D-глюкоза является правовращающим энантиомером, а D-фруктоза - левовращающим энантиомером.
В большинстве случаев биологическую активность проявляет только один из энантиомеров (в случае моносахаридов D-энантиомер). Это связано с тем, что для многих биохимических реакций геометрическое соответствие активных центров взаимодействующих оптически активных молекул чрезвычайно важно, подобно тому, как на правую руку можно надеть только правую перчатку, но не левую. В то же время в водных растворах моносахариды обычно существуют в виде равновесной смеси таутомеров, каждый из которых, являясь энантиомером, характеризуется своей величиной и знаком вращения плоскости поляризации света. Так, таутомер a-D-глюкопираноза имеет  , а таутомер B-D-глюкопираноза — +19°.
, а таутомер B-D-глюкопираноза — +19°.
При растворении кристаллических моносахаридов в воде, из-за достаточно медленного установления таутомерного равновесия, наблюдается постепенное изменение удельного вращения от величины, характерной для кристаллического образца, до постоянной (равновесной) величины, характерной для водного раствора данного моносахарида. Для водного раствора глюкозы равновесное значение 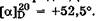 Изменение угла вращения плоскости поляризации света во времени при растворении углеводов называется мутаротацией. Причина мутаротации заключается в способности углеводов к существованию в растворе в виде равновесной смеси нециклического и циклических таутомеров (табл. 22.1), для каждого из которых характерно свое значение
Изменение угла вращения плоскости поляризации света во времени при растворении углеводов называется мутаротацией. Причина мутаротации заключается в способности углеводов к существованию в растворе в виде равновесной смеси нециклического и циклических таутомеров (табл. 22.1), для каждого из которых характерно свое значение 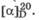

Достаточно медленное установление таутомерного равновесия объясняется тем, что в основе этого процесса лежат реакции электрофильно-нуклеофильного расщепления связи С—О в группе С—О—С и присоединения по карбонильной группе, скорости которых малы.
Производные моносахаридов. В молекулах производных моносахаридов, встречающихся в природе, вместо одной или нескольких гидроксильных групп содержатся другие заместители: Н, NH2, SH и др.
 |
Дезоксисахара. Моносахариды, в которых одна или несколько ОН-групп заменены на Н, называются дезоксисахарами. При гидролизе дезоксирибонуклеиновых кислот получают 2-дезоксирибозу, являющуюся производной рибозы, у которой нет гидроксильной группы при атоме С-2. В кристаллическом состоянии 2-дезоксирибоза существует в виде таутомеров - а- и B-фураноз.
В водных растворах 2-дезоксирибозы устанавливается тау-томерное равновесие между а- и Р-фуранозами, нециклическим таутомером и а- и Р-пиранозами. Химические свойства дезоксисахаров подобны свойствам моносахаридов.
Аминосахара (гликозамины) - моносахариды, содержащие NH2-группы вместо одной или нескольких ОН-групп. В зависимости от положения аминогруппы различают 2-амино-, 4-амино-, 2,6-диаминосахара. В природе наиболее распространены 2-аминоглюкоза и 2-аминогалактоза. Они встречаются в животных организмах и растениях в виде N-ацетилпроизводных, являющихся структурными компонентами гетерополисахаридов - хитина, гепарина, гиалуроновой кислоты и других.

Для аминосахаров характерны свойства как моносахаридов, так и аминов.
Дата публикования: 2014-10-16; Прочитано: 11764 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
