 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Кислотно-основные свойства и прототропная таутомерия
|
|
Наличие в молекулах а-аминокислот одновременно и кислотной, и основной групп (разд. 8.2) приводит не только к тому, что они амфолиты и могут существовать в виде двух прототропных таутомеров ТБИ и ТНС, но и к тому, что наиболее термодинамически устойчивым таутомером оказывается тот, в котором его функциональные группы, перейдя в заряженные формы, проявляют не прямые, а сопряженные, т. е. противоположные свойства. Поэтому в молекулах а-аминокислот из-за их биполярно-ионной структуры отрицательно заряженная карбоксильная группа проявляет основные свойства, а положительно заряженная аммонийная группа - кислотные свойства. Вследствие этого а-аминокислоты взаимодействуют и с кислотами, и а - щелочами, образуя разные типы солей, в которых аминокислоты выступают в виде или катиона, или аниона.
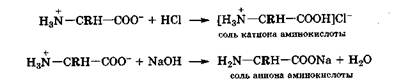
Аминокислоты, которые могут существовать только в трех формах: молекула, катион и анион, - называются нейтральными. Из 20 природных аминокислот 13 - нейтральные: аланин, аспарагин, валин, глицин, глутамин, изолейцин, лейцин, метионин, пролин, серии, треонин, триптофан, фенилаланин. Каждая из перечисленных аминокислот в водных растворах по мере увеличения значения рН может находиться в сильнокислой среде [рН < рKа(СООН) - 2] в виде катиона, при рН = рI - молекулы, а в щелочной среде  - аниона. В растворах с рН между указанными значениями аминокислоты находятся в слабокислой среде в виде смеси катиона и молекулы, а в слабоосновной среде - смеси молекулы и аниона.
- аниона. В растворах с рН между указанными значениями аминокислоты находятся в слабокислой среде в виде смеси катиона и молекулы, а в слабоосновной среде - смеси молекулы и аниона.

 |  | ||
Все нейтральные аминокислоты имеют близкие кислотно-основные показатели рКa(СООН) =2,0 - 3,0, рI = 5,5 + 6,5,
 9,0 - 10,5, причем рI вычисляется по формуле
9,0 - 10,5, причем рI вычисляется по формуле
Как видно из схемы, по значениям кислотно-основных характеристик нейтральных аминокислот можно установить, в виде каких частиц находится любая из этих кислот при данном значении рН ее водного раствора. Это чрезвычайно важно, так как каждая из указанных частиц: молекула, катион или анион аминокислоты - имеет не только отличные от других химические свойства, но и свое специфическое влияние на биологические и физиологические функции данной аминокислоты в живых системах. Кроме этого, знание кислотно-основных свойств аминокислот имеет исключительно важное значение для понимания многих свойств и функций пептидов и белков.
Своеобразие кислотно-основных свойств аминокислот проявляется и при изучении этих свойств с помощью потенциометри-ческого титрования щелочью. Прежде всего для этого нужно брать соль катиона аминокислоты, например глицингидрохло-рид. Эта соль при титровании щелочью выступает донором двух протонов.
Получаемая при этом кривая титрования (рис. 21.1) внешне очень похожа на кривые титрования обычных кислот (см. рис. 8.2), но интерпретация ее иная, так как она результат нейтрализации двух протонов, а не одного, как в случаях, проиллюстрированных на рис. 8.2. Поэтому имеющаяся на кривой

Кривая титрования глицингидрохлорида [H3NCH2COOH]Cl- титрования точка перегиба соответствует состоянию эквивалентности, достигаемому при добавлении 1 экв. щелочи, когда катион аминокислоты, отдав протон от карбоксильной группы, полностью перешел в молекулу. Поэтому рН системы в точке эквивалентности, где аминокислота находится только как молекула, соответствует изоэлектрической точке (рI) этой аминокислоты. Кривая титрования после точки эквивалентности характеризует процесс связывания второго протона, отрываемого от аммонийной группы аминокислоты.
С учетом перечисленных особенностей кривая титрования соли аминокислоты кроме определения ее рI позволяет определить значения ее рКа(СООH) и pKa(NH3). Значение рKа(СООН) устанавливают по кривой титрования по величине рН системы, содержащей 0,5 экв. щелочи, так как в этот момент в растворе находится 50 % катионов и 50 % молекул аминокислоты. Значение pKa(NH3) также устанавливают на основании кривой титрования, но по величине рН системы, содержащей 1,5 экв. щелочи, так как в этот момент в растворе находится 50 % молекул и 50 % анионов титруемой аминокислоты. Начальный и конечный участки кривой титрования не информативны, поскольку в эти моменты в системе происходит не только нейтрализация аминокислоты, но и гидролиз ее солей, где она выступает в кислой среде катионом, а в щелочной среде - анионом.
Аминокислоты кислотные содержат в заместителе дополнительную кислотную группу: аспарагиновая и глутаминовая кислоты - карбоксильную группу (СООН), цистеин – тиольную группу (SH), а тирозин - n-гидроксифенильную  Кислотные свойства этих групп характеризуются величиной pKa(R) (табл. 21.1). Все эти кислоты в водных растворах по мере уменьшения кислотности среды, т. е. возрастания рН, могут находиться в четырех формах: катиона, молекулы, моноаниона и дианиона (разд. 8.2), причем строение моноаниона зависит от того, какая из двух кислотных групп в молекуле ионизуется первой.
Кислотные свойства этих групп характеризуются величиной pKa(R) (табл. 21.1). Все эти кислоты в водных растворах по мере уменьшения кислотности среды, т. е. возрастания рН, могут находиться в четырех формах: катиона, молекулы, моноаниона и дианиона (разд. 8.2), причем строение моноаниона зависит от того, какая из двух кислотных групп в молекуле ионизуется первой.

В молекулах аспарагиновой и глутаминовой кислот, а также в цистеине вначале ионизуется кислотная группа заместителя, так как  поэтому строение их моноаниона "сложное", поскольку он содержит две отрицательно заряженные группы -СОO- и R- - и одну аммонийную группу, заряженную положительно. Для этих аминокислот изоэлектрическая точка вычисляется по формуле:
поэтому строение их моноаниона "сложное", поскольку он содержит две отрицательно заряженные группы -СОO- и R- - и одну аммонийную группу, заряженную положительно. Для этих аминокислот изоэлектрическая точка вычисляется по формуле: 
Аспарагиновая и глутаминовая кислоты в биологических средах (рН = 7) на 100 %, а цистеин - около 1 % находятся в виде моноаниона. Для аниона цистеина в растворе возможно таутомер-ное равновесие "сложный" моноанион  "простой" моноанион.
"простой" моноанион.
 |
Моноанион тирозина имеет строение "простого" таутомера, так как
 и его изоэлектрическая точка вычисляется по обычной формуле:
и его изоэлектрическая точка вычисляется по обычной формуле:
Аминокислоты основные содержат в заместителе основные группы (см. табл. 21.1). Поэтому лизин, аргинин и гистидин в водных растворах по мере уменьшения кислотности среды могут находиться в четырех формах: дикатиона, монокатиона, молекулы и аниона. Структура монокатиона основных аминокислот сложная, так как она содержит две положительно заряженные группы  и одну отрицательно заряженную группу (СОО-). Структура молекул этих кислот (а именно: какая основная группа несет положительный заряд) зависит от того, какая из двух прото-нированных основных групп в монокатионе ионизуется первой.
и одну отрицательно заряженную группу (СОО-). Структура молекул этих кислот (а именно: какая основная группа несет положительный заряд) зависит от того, какая из двух прото-нированных основных групп в монокатионе ионизуется первой.
 |
В случае молекул лизина и аргинина в растворе наиболее устойчив таутомер ТБИ II, а для гистидина характерно таутомер-ное равновесие с преобладанием ТБИ I. Изоэлектрическая точка основных аминокислот вычисляется по формуле:

В биологических средах (рН = 7) основные аминокислоты находятся в виде монокатиона, причем лизин и аргинин на 100 %, а гистидин - около 1 %. Эти кислоты являются активными акцепторами не только протонов, но и других комплексообразователей (катионов d-металлов), выступая полидентатными лигандами.
Знание кислотно-основных свойств аминокислот имеет исключительно важное значение для их разделения, идентификации и количественного анализа, так как позволяет осуществлять эти процессы с определенной формой данной аминокислоты (молекулой, катионом или анионом). Если в анализируемой системе имеется смесь указанных частиц, то это сильно затрудняет анализ аминокислот и снижает точность любого метода. Понимание особенностей кислотно-основных свойств аминокислот крайне необходимо для объяснения многих свойств пептидов и белков.
Дата публикования: 2014-10-16; Прочитано: 3637 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
