 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Химические свойства моносахаридов и их производных
|
|
Моносахариды, из-за склонности к кольчато-цепной таутомерии, могут реагировать как любой таутомер или как совокупность разных таутомеров.
Кислотно-основные свойства. Моносахариды, являясь многоатомными спиртами, подобно глицерину (рКа = 14,0), в водных растворах не проявляют кислотные свойства, о чем свидетельствует нейтральность среды этих растворов. В то же время в спиртовой среде при действии алкоголятов щелочных металлов они образуют соли - сахараты, которые в водной среде полностью гидролизуются:
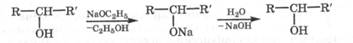
Под действием даже водных щелочей в моносахаридах донором протона может выступать также СН-группа, расположенная рядом с карбонильной группой. Поэтому в щелочной среде моносахариды подвергаются изомеризации, называемой эпимеризацией и сопровождаемой внутримолекулярной окислительно-восстановительной дисмутацией. Эти превращения рассмотрены далее при описании окислительно-восстановительных свойств.
В отличие от самих моносахаридов, их сложные эфиры с фосфорной или серной кислотой являются сильными кислотами. Так, монофосфаты любых моносахаридов R—ОРО(ОН)2 за счет фосфатной группировки являются двухосновными кислотами с 
Поэтому в любых биологических средах они полностью ионизованы по первой ступени, а при рН = 7 в значительной степени - по второй ступени. Моносульфаты моносахаридов R—OSO3H проявляют еще более сильные кислотные свойства (рКа < 0,4), и, следовательно, в биологических средах их сульфогруппа всегда ионизована полностью. Анионы фосфатов и сульфатов моносахаридов сосредоточены во внутриклеточных жидкостях, и они, в отличие от самих моносахаридов, не проходят сквозь клеточные мембраны.
Аминосахара R—NH2 за счет аминогруппы проявляют значительные основные свойства (рKа(ВН+) = 6 - 8).
Комплексообразующие свойства. Моносахариды, подобно глицерину, в водных растворах взаимодействуют со свежеобразованным гидроксидом меди с образованием сахаратов ярко-синего цвета, которые устойчивы, так как являются хелатными комплексами катиона меди:

Эта качественная реакция используется для обнаружения моносахаридов и для демонстрации того, что моносахариды и другие углеводы - многоатомное спирты.
Склонность к комплексообразованию у фосфатов и сульфатов моно- и полисахаридов резко возрастает. При этом из-за невысокой поляризуемости фосфатных и сульфатных групп они могут образовывать малоустойчивые комплексы с очень жесткими катионами К+ и Na+ и более устойчивые комплексы с менее жесткими катионами Mg2+ и Са2+. В результате комплексообразования, с одной стороны, происходит активация биосубстратов, содержащих фосфатные и сульфатные группы, под действием перечисленных катионов металлов, а с другой стороны - такие биосубстраты могут участвовать в минерально-солевом обмене и регулировать его.
Электрофильно-нуклеофильные свойства лежат в основе уже рассмотренной кольчато-цепной таутомерии моносахаридов (разд. 22.1). Образующиеся при этом циклические полуацетали содержат у аномерного углеродного атома гликозидную гидроксильную группу, проявляющую повышенную реакционную способность в реакциях с алкилирующими и ацилирующими реагентами. Гликозидная связь С—О легко расщепляется, и ее аномерный углеродный атом становится активным электрофилом. Так, при взаимодействии со спиртами или фенолами в присутствии безводного НСl происходит активация электрофильного центра на аномерном углеродном атоме и образуются циклические ацетали, называемые гликозидами (в действительности образуется смесь аномеров а- и Р-метилгликозидов):
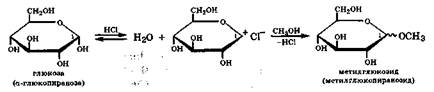
С целью упрощения в формулах циклических таутомеров моносахаридов по Хеуорсу часто не изображают символы атомов водорода и их связей с атомами углерода цикла. Если речь идет о смеси а- и B-аномеров, то гликозидную связь обозначают волнистой линией. Гликозиды, в отличие от простых эфиров, легко гидролизуются в кислой водной среде. Поскольку в гликозидах нет полуацетального гидроксила, то они не способны к кольчато-цепной таутомерии и, следовательно, к мутаротации.
В гликозиде моносахарида остальные гидроксильные группы выступают как нуклеофильные центры, и их водородные атомы замещаются при действии сильных алкилирующих реагентов с образованием полных простых эфиров моносахарида:

В названии полученного продукта гликозидная метильная группа специально выделена, чтобы подчеркнуть различие в химических свойствах ее и остальных четырех метоксигрупп. При действии воды, особенно в присутствии кислот, гликозидная группа легко гидролизуется, а простые эфирные группы сохраняются.
При обработке глюкозы уксусной кислотой происходит ацилирование только ее гликозидной ОН-группы. а при обработке уксусным ангидридом получается продукт полного ацилирования - ацетилтетраацетилглюкозид - полный сложный эфир глюкозы:

В живых организмах под действием аденозинтрифосфорной кислоты (АТФ) с участием ферментов происходит избирательное фосфорилирование только по гидроксильной группе при атоме С-6 глюкозы с образованием глюкозо-6-фосфата:

Окислительно-восстановительные свойства. В моносахаридах значения степеней окисления углеродных атомов изменяются от —1 до +2, поэтому они способны к окислительно-восстановительным реакциям, включая внутримолекулярную дисмутацию. Окислительно-восстановительные превращения моносахаридов для наглядности будем рассматривать на примере нециклического таутомера.
Эпимеризация моносахаридов. Обработка D-глюкозы основаниями способствует ее превращению в другие гексозы - D-маннозу и D-фруктозу. Молекулы D-глюкозы и D-маннозы различаются конфигурацией только углеродного атома в положении 2, и поэтому они являются эпимерами.
 |
Эпимерами называются диастереомеры, различающиеся конфигурацией только одного углеродного атома в молекуле. Химический процесс их взаимного превращения называется эпимеризацией.
В основе процесса эпимеризции находится кето-енольная таутомерия моносахаридов в щелочюй среде, сопровождаемая внутримолекулярной окислительноно - восстановительной дисмутацией атомов С-1 и С-2. Наличие в моюсахаридах карбонильной группы увеличивает подвижность зодородного атома при а - углеродном атоме, что приводит к повлению кето-енольной таутомерии у этих соединений. В данном случае в результате переноса протона от Са к кислородному тому карбонильной группы возникает промежуточный ендиол, который в результате различных таутомерных превращений образует три продукта: D-глюкозу, D-маннозу и D-фруктозу. Их сютношение зависит от условий проведения процесса: применение вместо Са(OOH)2 более слабых оснований повышает содержание D-маннозы и уменьшает количество D-фруктозы, а исполыование сильных оснований, наоборот, способствует образованию D-фруктозы.

В организме под действием рермента фосфороглюкоизом в результате эпимеризации из глэкозо-6-фосфата, а образуется фруктозо-6-фосфат, что является II стадией катаболизма глюкозы (разд. 22.1.2).
Альдольное расщепление межуглеродной связи. В организмах животных под действием фермента алъдолазы D-фруктозо-1,6-дифосфат расщепляется с образованием дигидроксиацетонфосфата и D-глицеринового альдегида-3-фосфата:
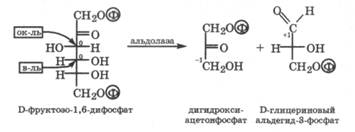
Расщепление межуглеродной связи С3-С4 сопровождается внутримолекулярной дисмутацией, причем соседний с электро-ноакцепторной карбонильной группой атом С-3 выступает как окислитель, принимая электрон от атома С-4 - восстановителя. Эта реакция альдольного расщепления является III стадией катаболизма глюкозы в организме (разд. 22.1.2). Интересно, что в растениях данная реакция протекает на одной из стадий фотосинтеза, но в обратном направлении, и служит для получения D-глюкозо-1,6-дифосфата.
Присоединение циановодорода. И альдозы, и ке-тозы легко вступают в реакцию присоединения циановодорода, образуя оксинитрилы, которые легко гидролизуются в гликоновые кислоты:

В данных реакциях дисмутации углеродный атом карбонильной группы выступает окислителем, а углеродный атом циановодорода - восстановителем. Благодаря этим реакциям моносахариды способны нейтрализовать вредное действие цианидов на организм животных.
Окисление моносахаридов. Для альдоз характерны реакции окисления альдегидной и первичной спиртовой групп, при этом в зависимости от условий образуются кислоты двух типов. Так, при окислении глюкозы бромной водой окисляется альдегидная группа и образуется глюконовая кислота. Кальциевая соль глюконовой кислоты (глюконат кальция) применяется в фармакотерапии в тех же случаях, что и хлорид кальция. При окислении глюкозы более сильным окислителем, например HNO3 или К2Сr2О7, окисляется не только углеродный атом альдегидной группы, но и углеродный атом первичной спиртовой группы. В результате образуется дикарбоновая кислота — глюкаровая кислота:
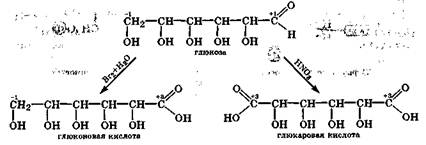
При действии сильных окислителей не на глюкозу, а на ее гликозид (в нем нет карбонильной группы) окисляется первичная спиртовая группа, и после гидролиза гликозидной группы образуется глюкуроновая кислота:
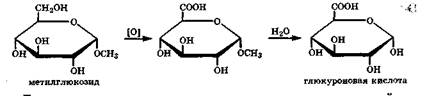
Глюкуроновая кислота проявляет все характерные свойства моносахаридов: кольчато-цепная таутомерия, мутаротация, эпимеризация. В организме глюкуроновая кислота в форме циклического таутомера — полуацеталя — участвует в процессе связывания и удаления ксенобиотиков, вступая в реакции нуклеофильного замещения своего гликозидного гидроксила на остаток —OR или —NHR ксенобиотика.
 |
Реакции мягкого окисления углеродного атома альдегидной группы катионами Ag+ и Сu2+ лежат в основе таких качественных реакций на альдозы, как реакция серебряного зеркала (реактив Толленса - аммиачный комплекс Ag+) или реакция образования Сu2О красно-коричневого цвета (реактив Феллинга -тартратный комплекс Си2+ или реактив Бенедикта - цитратный комплекс Сu2+).
В эти качественные реакции, проводимые в щелочной среде (реактивы Толленса или Феллинга), вступают и кетозы, которые в присутствии ионов ОН- вследствие эпимеризации изомеризуют-ся в альдозы. Углеводы, вступающие в эти реакции с указанными реагентами, называются восстанавливающими. Гликозиды не дают положительной пробы с этими реагентами, так как не могут самопроизвольно образовать альдозу.
Восстановление моносахаридов. При восстановлении в моносахаридах легко гидрируется их карбонильная группа, при этом образуются многоатомные спирты. Причем из альдоз получается лишь один спирт, а из кетоз - эквимолярная смесь спиртов-эпимеров:

Получающиеся в результате восстановления многоатомные спирты, например сорбит и ксилит, используются как заменители сахара при сахарном диабете. Многоатомные спирты образуют сложные эфиры, которые имеют практическое применение. Например, D-глюцит-гексанитрат (нитросорбит) и D-маннит-гексанитрат применяются как сосудорасширяющие средства.
Сильные восстановительные свойства проявляет аскорбиновая кислота (витамин С). Она содержится во фруктах, особенно цитрусовых, ягодах (шиповник, черная смородина), овощах и молоке. В промышленности ее получают из глюкозы. Особенности строения молекулы аскорбиновой кислоты заключаются в наличии у-лактонного кольца, содержащего ендиольный фрагмент, в котором два углеродных атома имеют степень окисления +1. Благодаря этим особенностям аскорбиновая кислота -довольно сильная кислота  и сильный восстановитель. При ее окислении образуется дегидроаскорбиновая кислота, которая в мягких условиях легко восстанавливается опять в аскорбиновую кислоту:
и сильный восстановитель. При ее окислении образуется дегидроаскорбиновая кислота, которая в мягких условиях легко восстанавливается опять в аскорбиновую кислоту:
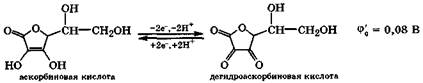
В организме в водной среде сопряженная восстановительно-окислительная пара - аскорбиновая кислота и дегидроаскорбиновая кислота - является активным антидотом свободнорадикальных окислительно-восстановительных процессов, протекание которых усиливается при различных патологических состояниях организма (разд. 9.3.9). Именно поэтому витамин С полезен и эффективен при многих заболеваниях.
Дата публикования: 2014-10-16; Прочитано: 9318 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
