 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Электрофильно-нуклеофильные свойства
|
|
Двойственная природа аминокислот, обусловленная наличием в молекуле и карбоксильной, и аминогруппы, проявляется также в электрофильно-нуклеофильных взаимодействиях. За счет карбонилсодержащего фрагмента они могут выступать как электрофилы, являясь донором ацильной группы, а за счет неподеленной электронной пары азотсодержащего фрагмента - как нуклеофилы. Это наглядно проявляется в реакциях ацилирования.
Реакции ацилирования. Аминокислоты в присутствии сильных кислот при взаимодействии со спиртами легко образуют аммонийные соли сложных эфиров, из которых при действии щелочи получают свободные эфиры:

Таким образом, в кислой среде, когда в аминокислотах аминогруппа блокирована протоном  аминокислоты выступают ацилирующим реагентом, т. е. донором ацильной группы, пцилируя в приведенной реакции молекулу спирта.
аминокислоты выступают ацилирующим реагентом, т. е. донором ацильной группы, пцилируя в приведенной реакции молекулу спирта.
В то же время в щелочной среде аминокислоты за счет свободной аминогруппы выступают акцептором ацильной группы от сильного ацилирующего реагента, например хлорангидрида карбоновой кислоты:

Приведенные реакции свидетельствуют, что в аминокислотах ацилирование протекает и по карбоксильной, и по аминогруппе. Поэтому когда в лабораторных условиях необходимо, чтобы в аминокислотах реагировала только одна из этих групп, другая должна быть защищена, т. е. инактивирована.
Карбонилсодержащий фрагмент аминокислоты в сильнощелочной среде защищается за счет образования соли карбоновой кислоты, а в других случаях - путем превращения его в сложноэфирную (— COOR') или в другую группировку, где электрофильность карбонильного атома углерода резко снижена из-за появления сильного электронодонора в группе.
 |
Аминогруппа в аминокислотах защищается в сильнокислой среде за счет ее протонирования (Н3Т+), а в других случаях - путем ее ацилирования (R'CONH—), т. е. появления у аминогруппы электроноакцептора, уменьшающего нуклеофильность атома азота. Таким образом, перечисленные способы защиты функциональных групп аминокислот заключаются в том, что снижается электрофильность карбонильного атома углерода в результате введения сильного электронодонора или снижается нуклеофильность атома азота аминогруппы за счет сильного электроноакцептора. Для удобства в формулах аминокислот, защищенных по карбоксильной или по аминогруппе, вместо формулы защитной группы будет использоваться соответственно знак •, символизирующий нуклеофильность, или знак о - электрофильность:
Вводимые защитные группы должны отвечать следующим требованиям: легко и избирательно вводиться в молекулу; надежно инактивировать защищаемую группу; легко удаляться из молекулы. Для удаления защитных групп в основном используется реакция гидролиза, но могут применяться и другие реакции, например их восстановление.
Аминокислоты с защищенной аминогруппой легко вступают в реакции ацилирования, характерные для карбоновых кислот, например, образуют хлорангидриды или смешанные ангидриды аминокислот:

В образовавшихся производных аминокислот происходит активация электрофильности карбонильного атома углерода. Карбонильный фрагмент с повышенной электрофильностью для
краткости будем обозначать  Эти соединения легко ацилируют спирты или амины с образованием сложных эфиров или амидов аминокислот соответственно:
Эти соединения легко ацилируют спирты или амины с образованием сложных эфиров или амидов аминокислот соответственно:

В организме аспарагиновая и глутаминовая кислоты под действием соответствующих ферментов и АТФ легко ацилируют аммиак с образованием аспарагина и глутамина соответственно:

 |
При ацилировании аминокислот со свободной аминогруппой аминокислотой с активированной карбонильной группой образуются дипептиды, в которых и амино-, и карбоксильная группы защищены. Эти защиты легко снимаются путем гидролиза:
Таким способом получают также три-, тетра- и полипептиды, в которых аминокислоты связаны между собой пептидной связью —СО—NH—, характерной и для белков. В организме пептиды синтезируются прямо из аминокислот, но при участии соответствующих ферментов.
При отсутствии защитных групп молекулы а-аминокислот при нагревании вступают в реакцию взаимного ацилирования, отщепляя межмолекулярно две молекулы воды и образуя циклическое соединение дикетопиперазин:

Реакции алкилирования. Аминокислоты, защищенные по карбоксильной группе, легко вступают в реакции электрофильного замещения, характерные для аминов, например ацилирования, которая рассмотрена выше, или алкилирования. Протеканию реакции алкилирования атома азота аминокислот способствует щелочная среда, так как в ней происходит связывание продуктов реакции:

Образующееся в итоге соединение имеет фиксированную биполярно-ионную структуру и называется бетаином аминокислоты, а в случае глицина (R = Н) - просто бетаином. В бетаине атом азота несет положительный заряд и является электрофильным центром. Поэтому бетаин может быть источником метильной группы для нуклеофильного центра другого соединения, т. е. метилирующим реагентом. В организме с помощью бетаина протекает реакция трансметилирования, например алкилирование гомоцистеина с образованием метионина:

Высокая нуклеофильность атома азота ос-аминокислот позволяет проалкилировать его 2,4-динитрофторбензолом (ДНФБ, реактив Сэнджера). В этом соединении электрофильность бензольного ядра вследствие влияния двух сильных электроноакцепторных нитрогрупп значительно повышена, что сильно увеличивает способность атома фтора вступать в реакцию замещения:

Образующееся динитрофенильное производное аминокислоты легко выделяется и идентифицируется хроматографически. Метод служит для определения аминокислотной последовательности белка, т. е. его первичной структуры.
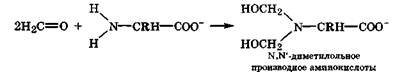 |
Реакция с формальдегидом. В слабощелочной среде (рН = 7), когда ос-аминокислоты частично переходят в моноанион, содержащий свободную аминогруппу, они легко вступают в реакцию нуклеофильного присоединения к формальдегиду. При избытке формальдегида образуется N, N'-диметилольное производное аминокислоты:
В таких производных аминокислот основность атома азота из-за электроноакцепторных заместителей сильно понижена. Это позволяет использовать реакцию с формальдегидом для количественного определения ос-аминокислот методом формольного титрования (метод Сёренсена), где в качестве титранта используется щелочь (индикатор фенолфталеин). Большая склонность аминогрупп в аминокислотах или белках реагировать с формальдегидом приводит к необратимой денатурации белков в его присутствии. Этим объясняются высокая токсичность формальдегида и его стерилизирующая способность.
Дата публикования: 2014-10-16; Прочитано: 3348 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
