 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Окислительно-восстановительные свойства
|
|
ос-Аминокислоты вступают в разнообразные окислительно-восстановителъные реакции, сопровождаемые изменением степеней окисления углеродных атомов и углеродного скелета молекулы. Эти реакции происходят как внутримолекулярно, так и межмолекулярно. Однако среди всех природных а-аминокислот особенно чувствителен к действию окислителей цистеин, легко окисляемый за счет атома серы тиольной группы (—SH) в цистин, содержащий дисульфидную группировку (—S—S—) (разд. 9.3.9, 12.2.6).
Тиол-дисульфидное равновесие. Цистеин, как все тиолы (разд. 17.2), выступая восстановителем, легко окисляется, образуя цистин, являющийся дисульфидом цистеина и сопряженным ему окислителем.

Цистеин и цистин составляют сопряженную восстановительно-окислительную пару (вопреки правилам, исторически на первое место поставлена восстановленная форма), для которой характерно тиол-дисульфидное равновесие. Значение нормального восстановительного потенциала этой пары  свидетельствует, что восстановительные свойства у нее преобладают над окислительными. Поэтому цистеин является эффективным антиоксидантом, выполняя защитные функции при воздействии на организм сильных окислителей благодаря восстановительным свойствам тиольной группы (разд. 9.3.9, 12.2.6).
свидетельствует, что восстановительные свойства у нее преобладают над окислительными. Поэтому цистеин является эффективным антиоксидантом, выполняя защитные функции при воздействии на организм сильных окислителей благодаря восстановительным свойствам тиольной группы (разд. 9.3.9, 12.2.6).
В то же время цистеин был первым препаратом, проявившим противолучевое действие, который уменьшал степень лучевого поражения и повышал выживаемость больных. При радиационном воздействии в водных средах организма возникают сильные окислители  называемые активными или токсичными формами кислорода (разд. 9.3.9, 12.2.5). Наряду с окислителями при этом воздействии в организме возникают другие токсиканты — короткоживущие сильные восстановители: гидратированный электрон (е-гидр) и атомарный водород Н*. Компоненты сопряженной восстановительно-окислительной пары цистеин - цистин активно взаимодействуют и с теми и другими агрессивно-токсичными частицами, нейтрализуя их. Именно этим объясняется эффективность цистеина при остром лучевом поражении. Легкое и быстрое за счет цистеинредуктазы взаимодействие тиольных групп двух Молекул цистеина с образованием дисульфидной связи цистина и обратимость этой реакции играют важную роль в регуляции процессов обмена в организме. Превращение цистеина в цистин приводит к образованию дисульфидной связи в пептидах и белках, влияя на их конформацию (разд. 21.3 и 21.4).
называемые активными или токсичными формами кислорода (разд. 9.3.9, 12.2.5). Наряду с окислителями при этом воздействии в организме возникают другие токсиканты — короткоживущие сильные восстановители: гидратированный электрон (е-гидр) и атомарный водород Н*. Компоненты сопряженной восстановительно-окислительной пары цистеин - цистин активно взаимодействуют и с теми и другими агрессивно-токсичными частицами, нейтрализуя их. Именно этим объясняется эффективность цистеина при остром лучевом поражении. Легкое и быстрое за счет цистеинредуктазы взаимодействие тиольных групп двух Молекул цистеина с образованием дисульфидной связи цистина и обратимость этой реакции играют важную роль в регуляции процессов обмена в организме. Превращение цистеина в цистин приводит к образованию дисульфидной связи в пептидах и белках, влияя на их конформацию (разд. 21.3 и 21.4).
При исчерпывающем окислении тиольной группы цистеина последний переходит в цистеиновую кислоту, содержащую сульфогруппу. Появление в молекуле еще одной сильной кислотной и электроноакцепторной группы способствует протеканию реакции декарбоксилирования с образованием таурина:
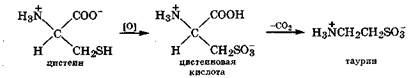
Таурин, взаимодействуя с холевой кислотой, образует тау-рохолевую кислоту, принимающую активное участие в эмульгировании и всасывании жиров (разд. 20.3).
Разнообразные окислительно-восстановительные реакции а-аминокислот с участием углеродных атомов протекают как в организмах, так и вне их. В организме направление и скорость этих реакций определяются ферментом и коферментом, участвующих в них.
 |
Декарбоксилирование. В а-аминокислотах электроноакцепторная группа — NH3 расположена в а-положении к группе —СОО-, также проявляющей электроноакцепторные свойства. Это сильно поляризует связь Ca-C1, повышая электрофильность и нуклео-фильность ее углеродных атомов и способствуя внутримолекулярной окислительно-восстановительной дисмутации между ними вплоть до расщепления указанной связи с образованием СС2, т. е. декарбоксилированием. В лабораторных условиях эта реакция протекает при нагревании а-аминокислот в присутствии Ва(ОН)2:
В организме процесс происходит в комплексе:

Вначале а-аминокислота в этом комплексе реагирует с альдегидной группой пиридоксальфосфата, образуя так называемый альдимин, в котором под действием декарбоксилазы происходят поляризация и разрыв связи Ca-C1. При этом отщепляется СO2, а в результате гидролиза альдимина образуется амин и регенерируется пиридоксальфосфат:
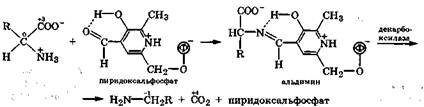
При декарбоксилировании а-аминокислот в организме синтезируются биогенные амины, выполняющие важные биологические функции:

Декарбоксилирование аминокислот происходит сравнительно легко в тканях животных и растений, но особенно оно характерно для микроорганизмов.
Альдольное расщепление межуглеродной связи 
а-Аминокислоты, содержащие в р-положении электроноак-цепторную гидроксильную группу (серии, треонин), образуют с коферментом пиридоксалъфосфатом альдимин, в котором под действием альдолазы связь  сильно поляризуется, что приводит к ее разрыву, сопровождающемуся внутримолекулярной дисмутацией между атомами углерода. При этом образуется глицин и, в случае серина, формальдегид, а из треонина - аце-тальдегид.
сильно поляризуется, что приводит к ее разрыву, сопровождающемуся внутримолекулярной дисмутацией между атомами углерода. При этом образуется глицин и, в случае серина, формальдегид, а из треонина - аце-тальдегид.

Прямое дезаминирование. Этот процесс характерен для а-аминокислот, у которых в B-положении содержатся легко уходящие электроноакцепторные группы: гидроксильная или тиольная. В альдимине, образуемом пиридоксальфосфатом с сери-ном, треонином или цистеином, под действием соответствующего фермента сильно поляризуется связь Са—Н, что приводит к внутримолекулярному отщеплению Н2О или H2S с образованием енаминокислоты. Прототропная таутомерная перегруппировка енаминокислоты в a-иминокислоту и гидролиз последней с образованием соответствующей а-оксокислоты протекает быстро и без участия ферментов:

В этом случае и реакция отщепления (I стадия), и прототропная енамин-иминная таутомерия (II стадия) сопровождаются внутримолекулярной дисмутацией за счет углеродных атомов Са и СB, на что указывает изменение значений их степеней окисления. Непосредственное удаление аминогруппы при прямом дезаминировании происходит в результате гидролиза возникающей а-аминокислоты.
 |
Трансаминирование. Процесс трансаминирования между а-аминокислотой и а-оксокислотой в организме происходит с участием кофермента пиридоксалъфосфата и соответствующей трансаминазы. Суть этого процесса состоит в передаче аминогруппы от а-аминокислоты, выступающей донором аминогруппы, на a-оксокислоту, являющуюся акцептором аминогруппы:
Кофермент пиридоксальфосфат выполняет функцию переносчика аминогруппы:

Сначала пиридоксальфосфат за счет альдегидной группы образует с молекулой а-аминокислоты имин I, который в результате иминиминной таутомерии (разд. 18.2.3) превращается в имин II с иным положением кратной связи C=N. Этот имин гидролизуется, образуя а-оксокислоту и пиридоксаминфосфат. С пири-доксаминфосфатом взаимодействует другая а-оксокислота, и реакция протекает в обратном направлении, давая новую а-аминокислоту и пиридоксальфосфат. Реакция трансаминирования является межмолекулярным окислительно-восстановительным процессом, в котором участвуют углеродные атомы не только взаимодействующих кислот, но и пиридоксальфосфата. С помощью этой реакции устраняется избыток отдельных а-амино-кислот и регулируется их содержание в клетках.
Окислительное дезаминирование. Этот процесс характерен для a-аминокислот при действии на них окислителей и протекает как в лабораторных условиях, так и в организме.
Взаимодействие с азотистой кислотой. При взаимодействии с таким сильным окислителем, как азотистая кислота, а-аминокислоты в лабораторных условиях превращаются в а-гидроксикислоты с выделением азота и воды:

Это реакция межмолекулярной окислительно-восстановительной дисмутации за счет атомов азота. Она используется для количественного определения аминных групп в аминокислотах, а также в белках и продуктах их распада.
Частичное дезаминирование аргинина молекулярным кислородом. В последнее время открыт новый фермент NO-синтаза, под действием которого при окислении аргинина и кофермента НАДФ(Н) молекулярным кислородом образуется оксид азота(2) и цитрулин:

Полученный оксид азота(2) быстро используется в иммунной системе для устранения ксенобиотиков, а также для регуляции кровяного давления за счет расслабления мышц кровеносных сосудов.
 |
Взаимодействие с нингидрином. Общая качественная реакция а-аминокислот заключается во взаимодействии с нингидрином в водных растворах при нагревании с появлением сине-фиолетовой окраски, интенсивность которой пропорциональна концентрации а-аминокислот. Это реакция окисления а-аминокислот нингидрином, сопровождаемая их дезаминированием и декарбоксилированием, а также образованием красителя из нингидрина с участием растворенного в воде кислорода:
В этом случае окисляются углеродные атомы Cl и Са аминокислоты, а восстанавливаются углеродный атом нингидрина и молекула кислорода. Нингидриновая реакция широко используется для визуального обнаружения а-аминокислот при проявлении хроматограмм и электрофореграмм.
Взаимодействие с дегидрогеназой. В организме аланин, аспарагиновая и глутаминовая кислоты подвергаются окислительному дезаминированию под действием соответствующих дегидрогеназ с коферментом НАД+ или НАДФ+. На первой стадии процесса происходит реакция дегидрирования (окисления) а-аминокислоты в а-иминокислоту под действием окисленной формы кофермента НАД+ или НАДФ+ в субстрат-ферментном комплексе:

На второй стадии без участия фермента а-иминокислота гидролизуется в соответствующую а-оксокислоту:

Характерной особенностью окислительного дезаминирова-ния аминокислот является то, что этот процесс может протекать в обратном направлении, т. е. возможно восстановительное аминирование 2-оксокислот. Таким путем в организме из 2-оксоглутарата и иона аммония образуется глутамат.
Внутримолекулярное дезаминирование. Аспарагиновая кислота из-за наличия в молекуле еще одной сильной электроноакцепторной группы (СООН) легко вступает под действием аспартат-аммиак-лиазы в реакцию внутримолекулярного дезаминирования, образуя фумарат аммония:

Реакция сопровождается отщеплением иона аммония и внутримолекулярной дисмутацией углеродных атомов  и
и  и носит обратимый характер. В микробиологической промышленности из фумарата аммония с помощью клеток кишечной палочки, содержащих аспартат-аммиак-лиазу, синтезируют L-acпарагиновую кислоту.
и носит обратимый характер. В микробиологической промышленности из фумарата аммония с помощью клеток кишечной палочки, содержащих аспартат-аммиак-лиазу, синтезируют L-acпарагиновую кислоту.
Завершая рассмотрение окислительно-восстановительных свойств а-аминокислот, следует еще раз подчеркнуть, что в организмах в основном это реакции внутри- или межмолекулярной дисмутации углеродных атомов. При этом в а-аминокислотах лабильной оказывается любая связь а-углеродного атома с соседними атомами, а сам Са, имея нулевую степень окисления, может быть и окислителем, и восстановителем. Установлено, что разрывается та связь, которая расположена перпендикулярно плоскости сопряженной системы субстрат — кофермент.
Дата публикования: 2014-10-16; Прочитано: 6402 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
