 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Разрушение озонового слоя
|
|
Озоновый слой в стратосфере играет жизненно важную роль в предохранении всего живого на Земле от губительной ультрафиолетовой радиации. Особенно эффективно она поглощается озоном в диапазоне длин волн 200-310 нм. Другие атмосферные газы в этом диапазоне практически прозрачны.
Разложение озона вызывает не только ультрафиолетовая радиация, но и взаимодействие с радикальными частицами. Особенно активно с озоном взаимодействуют оксиды азота N0 и NO2, в молекулах которых имеются неспаренные электроны, а также атомарный хлор:

Каждая из этих пар реакций в сумме приводит к исчезновению озона и атомарного кислорода, тогда как оксиды азота и атомарный хлор постоянно регенерируются. Таким образом, эти процессы являются автокаталитическими, и каждая из таких частиц вызывает разрушение большого количества озона. В настоящее время отмечается уменьшение толщины озонового слоя.
Заметными источниками поступления оксидов азота в стратосферу является запуск ракет и высотные полеты реактивных самолетов. Что касается атомарного хлора, то в 80-е годы XX века был поднят вопрос о так называемой "фреоновой опасности". Считалось, что основным источником поступления атомарного хлора в стратосферу являются процессы фотохимического разложения фторхлоруглеродов (фреонов), в частности CF2Cl2 и CFCl3, широко применяемых в холодильных установках и аэрозольных баллончиках. В настоящее время доказано, что эта опасность сильно преувеличена, однако угроза разрушения озонового слоя остается и требует дальнейшего изучения.

 14.2. МЕТОДЫ АНАЛИЗА ТОКСИКАНТОВ И МЕТОДЫ СНИЖЕНИЯ ИХ ПОСТУПЛЕНИЯ В АТМОСФЕРУ
14.2. МЕТОДЫ АНАЛИЗА ТОКСИКАНТОВ И МЕТОДЫ СНИЖЕНИЯ ИХ ПОСТУПЛЕНИЯ В АТМОСФЕРУ
Для поддержания должной чистоты атмосферы необходим постоянный контроль за чистотой воздуха в больших городах и вблизи промышленных предприятий. Контроль подразумевает обнаружение и количественное определение токсичных веществ: S02, NO, N02, СО, С02, H2S, NH3. Для анализа проба воздуха пропускается через ряд поглотителей, в которых используются растворы щелочей (для S02, N02, С02, H2S), кислот (для NH3), или твердые адсорбенты, пропитанные растворами соответствующих соединений. С помощью специфических реакций осуществляются идентификация и контроль за содержанием токсикантов в пробе.
 |
S02- Определение оксида серы(4) проводят, пропуская пробу воздуха через раствор иода, так как из-за достаточно сильных восстановительных свойств S02 реагирует с иодом. В присутствии S02 бурая окраска поглотительного раствора, содержащего иод, исчезает:
Для количественного определения S02 его поглощают раствором КОН и после нейтрализации поглотительного раствора используют метод иодометрии (принцип обратного титрования):

Уменьшить загрязнение атмосферы S02 позволяют следующие методы:
- переход к топливу с низким содержанием серы, т. е. замена угля и нефти природным газом;
- удаление S02 из дымовых газов путем введения в топку распыленных гашеной извести Са(0Н)2 или мела СаС03, связывающих S02 в присутствии кислорода в сульфат кальция:

- установка фильтров, улавливающих S02;
- увеличение высоты труб, отводящих продукты сгорания топлива. (Для крупных объектов высота труб должна превышать 400 м.)
NO2, N0. Оксид азота(4) обнаруживается после поглощения пробы воздуха раствором КОН. В растворах щелочей N02 в результате реакции окислительно-восстановительной дисмутации образует ионы N02 и N03:
 |
Обнаружить образовавшиеся ионы можно с помощью раствора дифениламина, который в их присутствии дает синее окрашивание, или реакцией их восстановления в щелочной среде до аммиака, открываемого с помощью реактива Несслера:

Количественное определение N0 и N02 проводится путем измерения объема азота, выделившегося в реакции их каталитического восстановления в присутствии платины:

Образовавшиеся оксид углерода(4) и вода отделяются с помощью концентрированного раствора щелочи.
Для уменьшения концентрации N0 и N02 в выхлопных газах автомобилей следует использовать высококачественный бензин, снижать скорость автомобилей в черте города. Наиболее радикальными мерами в борьбе за уменьшение поступления N0 и N02 от автотранспорта является замена бензина на газообразное топливо и переход на электромобили.
В промышленности очистка нитрозных газов осуществляется или каталитическим восстановлением их метаном (см. выше), или реакцией окисления N0 до N02 с последующим поглощением N02 водными растворами щелочей в присутствии кислорода:

СО. Оксид углерода(2) является сильным восстановителем, но при высоких температурах. Для аналитических целей в качестве окислителя используется раствор соли PdCl2, образующий при наличии СО черный осадок металлического палладия:

Количественное определение СО основано на реакции восстановления I2О6: 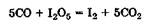
Выделившийся иод оттитровывают тиосульфатом (метод иодометрии) в присутствии крахмала.
Снижение содержания СО в выхлопных газах автотранспорта в основном достигается совершенствованием конструкции двигателей, чтобы увеличить приток кислорода в камеру сгорания, а также снижением числа остановок автотранспорта в черте города.
Удаление больших количеств СО из промышленных отходов основано на реакции образования водяного газа:

Оставшийся СО удаляют каталитическим восстановлением чистым водородом в присутствии катализатора NiO • А1203:

H2S. О наличии сероводорода в воздухе можно судить, если пропустить пробу воздуха через растворы солей (CH3OO)2Cd или
(CH3COO)2Pb:

 |
Количественное определение сероводорода проводят методом иодометрии, используя принципобратного титрования:
Очистка газообразных выбросов от сероводорода основана на использовании его кислотных свойств. Для поглощения Н S смесь газов пропускают через растворы оснований: NaOH или этаноламинов (H2NC2H4OH или HN(C2H4OH)2):

NH3. Определение аммиака в воздухе производится специфической реакцией, в которой используется реактив Несслера:

Цвет образующегося осадка зависит от количества аммиака в воздухе. Он меняется от желтого (малые количества) до красно-бурого при большом содержании аммиака. Если количество аммиака мало, его концентрация определяется спектрофотомет-рическим методом. Макроколичества аммиака определяются по изменению объема газовой пробы до и после поглощения растворами серной кислоты:
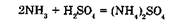
Очистка газов от аммиака осуществляется водными растворами кислот.
РЬ, РЬО, РЬ02. Пробу воздуха, содержащую свинец и его оксиды в виде аэрозолей, пропускают через раствор азотной кислоты:

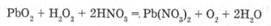 |
Нерастворившийся РbО2, обрабатывают пероксидом водорода в кислой среде:
Из полученного раствора свинец осаждают в виде желтого осадка хромата свинца:

Количественно свинец определяется по массе выделившегося осадка.
Чтобы не загрязнять атмосферу свинцом, необходимо отказаться от добавок его соединений в бензин. Расчет на фильтры, устанавливаемые на автомобилях, не оправдался.
Hg. Ртуть - единственный металл, находящийся при обычной температуре в жидком состоянии (Tпл = -39 °С). Основным источником ртутных загрязнений на бытовом уровне являются разбитые ртутные термометры и манометры, а также лампы дневного света.
В промышленности ртуть используется в электротехническом и электрометаллургическом производствах, отходы которых создают серьезную экологическую проблему, так как ртуть и ее соединения сильно ядовиты!
Из солей ртути хорошо известны каломель Hg2Cl2 и сулема HgCl2. Наряду с обычными солями - хлоридами, сульфатами, нитратами - Hg(II) легко образует металлорганические соединения типа RHgX и R2Hg. С точки зрения токсикологии наиболее важными являются метилртутные соединения, так как они могут образовываться в организме за счет метилирования биосубстратами поступивших соединений ртути. В отличие от неорганических солей ртути, они способны проникать в клеточные мембраны и накапливаться в жировой ткани.
Соединения ртути(1) в присутствии веществ, содержащих тиольные группы, подвергаются окислительно-восстановительной дис-мутации: 
Соединения ртути(2) образуют устойчивые комплексы с биологически важными молекулами. Это приводит к денатурации белков и ингибированию ферментов:

Защитным действием против отравления ртутью обладают хелатирующие препараты, содержащие тиольные группы (унитиол, сукцимер), а также тиосульфат натрия (гл. 10 и 12).
Для качественного определения иона ртути используется раствор KI. При недостатке KI в присутствии Hg2+ образуется характерный красный осадок, который в избытке KI растворяется вследствие комплексообразования:

Для ликвидации загрязнения помещений металлической ртутью необходима их обработка или раствором FeCl3, или элементарной серой:

Пролитую ртуть можно засыпать мелким порошком цинка или меди и иодсодержащим углем.
Дата публикования: 2014-10-16; Прочитано: 1389 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
