 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Железо и кобальт
|
|
В организме человека содержится около 5 г железа и 1,2 мг кобальта. Большая часть железа (70 %) сосредоточена в гемоглобине крови; 14 % кобальта находится в костях, 43 % - в мышцах и остальная часть - в мягких тканях. Ежедневное потребление железа - 10-20 мг, а кобальта - 0,3 мг.
Железо и кобальт - элементы 4 периода VIIIБ группы периодической системы с электронными конфигурациями 26Fe: 1s22s22p63s23p63d64s2; 27Со: 1 s22s22p63s23p63d4s2.
Орбитальные радиусы, энергия ионизации и электроотрицательность для атомов Fe и Со составляют соответственно: rорб -123 и 118 пм, Eи - 761 и 757 кДж/моль, ОЭО - 1,83 и 1,88. Наиболее характерные степени окисления для железа и кобальта +2 и +3.
В водных растворах катионы Fe2+, Fe3+, Со2+ и Со3+ гидратируются с образованием шестикоординационных аквакомплексов. Аквакомплексы [Ре(Н20)б]3+ и [Со(Н20)б]2+ устойчивы, [Fe(H2O)6]2+ малоустойчив из-за восстановительных свойств Fe2+, а [Со(Н20)б]3+ неустойчив из-за сильных окислительных свойств Со.

Таким образом, Fe2+ - достаточно сильный восстановитель, способный окисляться даже кислородом воздуха, а Со3+ - настолько сильный окислитель, что окисляет даже воду:

 |
Оксиды и гидроксиды железа и кобальта независимо от степени окисления проявляют слабые амфотерные свойства с преобладанием основных свойств, особенно в случае двухвалентного состояния, когда взаимодействие протекает только с концентрированными растворами щелочей и при нагревании. Однако взаимодействие СоООН (устойчивая форма) с соляной или серной кислотой осложняется протеканием окислительно-восстановительной реакции из-за сильных окислительных свойств Со3+.
 |
Вследствие амфотерности оксидов железа и кобальта они образуют двойные оксиды Fe304(FeO • Fe203), Со304(СоО*Со203), которые можно рассматривать как соли Fe(Fe02)2 и Со(Со02)2. Оксид Fe304, растворяясь в соляной кислоте, образует соли двух- и трехвалентного железа, а взаимодействие Со304 сопровождается образованием СоСb и хлора:
Водные растворы железа и кобальта вследствие образования аквакомплексов окрашены по-разному: |Fе(Н20)б]2+ - бледно-зеленый, [Fе(Н20)б]3+ - желтый, [Со(Н20)6]2+ - розово-красный, что используется в аналитической практике.
Катионы железа и кобальта очень склонны к комплексообразованию. Для них наиболее вероятно координационное число шесть:

Комплексообразование катионов железа и кобальта сильно, но по-разному влияет на их окислительно-восстановительные свойства в зависимости от соотношения устойчивости комплексов окисленной (М3+) и восстановленной (М2+) форм с одними и теми же лигандами (разд. 10.3). Эта особенность окислительно-восстановительных свойств ионов железа в их биокомплексах важна для понимания работы цитохромов и различий в их окислительно-восстановительных свойствах (разд. 9.3). Комплексообразование Со3+ с лигандами более активными, чем молекулы воды, делает его устойчивым в водных растворах.
Биологическая роль железа. К наиболее важным железосодержащим биосубстратам относятся гемоглобин и различные его производные, строение, функции и свойства которых были уже рассмотрены (разд. 10.4). Существует большая группа, около 50 видов, железосодержащих ферментов - цитохромов, которые катализируют процесс переноса электронов в дыхательной цепи за счет изменения степени окисления железа 
(разд. 9.3 и 10.4). Железосодержащими ферментами также являются каталаза и пероксидаза, активные центры которых со держат железо в степени окисления +3. Каталаза чрезвычайно эффективно ускоряет разложение пероксида водорода: одна молекула каталазы за 1 с может разложить до 44 000 молекул Н2О2. Пероксидаза ускоряет реакции окислительного дегидрирования субстратов RH2 пероксидом водорода:

Таким образом, эти ферменты защищают клетку от Н202 - продукта свободнорадикального окисления.
В процессе эволюции природа создала замкнутый цикл использования железа. Все субстраты, содержащие гемовое железо (прежде всего, эритроциты), после использования разлагаются до катионов Fe3+, которые депонируются в виде молекул FeOOH и FeO • Н2РО4 с помощью белка ферритина. Молекула ферритина имеет форму полой сферы диаметром 12-14 нм, в которой может находиться до 4500 таких молекул, упакованных очень плотно, почти как в кристаллической решетке. От ферритина железо переносится железосодержащим белком - трансферрином, который достаточно легко проходит через клеточную мембрану и доставляет железо в костный мозг, где образуется гемоглобин в новых эритроцитах.
Важную роль в организме играют многоядерные комплексы ферредоксин, рубредоксин и другие железосеропротеины общей формулы  . Активный центр этих комплексов имеет структуру "клетки", где кроме атомов железа (х = 1- 8) содержатся атомы серы двух типов: из остатков цистеина, входящих в состав протеина, и так называемая "лабильная сера", природа которой не выяснена. Железосеропротеины являются компонентами различных электроно-транспортных цепей и осуществляют перенос электронов за счет обратимых окислительно-восстановительных превращений.
. Активный центр этих комплексов имеет структуру "клетки", где кроме атомов железа (х = 1- 8) содержатся атомы серы двух типов: из остатков цистеина, входящих в состав протеина, и так называемая "лабильная сера", природа которой не выяснена. Железосеропротеины являются компонентами различных электроно-транспортных цепей и осуществляют перенос электронов за счет обратимых окислительно-восстановительных превращений.
При недостатке железа в организме (или большой потере его) развивается железодефицитная анемия. Для пополнения запасов железа ежедневная необходимая доза составляет 1 мг, но поскольку из пищи поступает в организм только 10-20 % железа, то в продуктах питания содержание железа должно составлять 5-10 мг/сут. При слабости и истощении организма, а также для лечения железодефицитной анемии применяют аскорбинат железа(2), лактат железа(2), FeS04*7H20, "ферроплекс" (FeS04 с аскорбиновой кислотой), глицерофосфат железа(3).
Биологическая роль кобальта. Кобальт в организме в основном содержится в витамине B12, который является сложным азотсодержащим органическим комплексом Со3+ с координационным числом, равным шести. Витамин В12 необходим для нормального кроветворения и созревания эритроцитов, синтеза аминокислот, белков, РНК, ДНК и других соединений, без которых нормальное развитие организма невозможно. Накапливается витамин В12 в печени. Его недостаток в организме вызывает злокачественную анемию.
 |
Механизм действия витамина B12 заключается в том, что некоторые его формы образуют в качестве кофермента соединения с витамином B6 или с некоторыми ферментами. В этих случаях он выполняет две основные функции: является метилирующим агентом или осуществляет взаимный перенос атомов водорода и различных групп между соседними атомами углерода биосубстрата. При этом кобальт восстанавливается:
МЕДЬ
В организме взрослого человека содержится около 100 мг меди. В основном медь концентрируется в печени, в головном мозге, в крови. Средняя дневная доза потребления меди для человека 4-5 мг.
Медь - элемент 4 периода периодической системы, 1Б группы. На внешнем уровне находится только один 4s-электрон, зато Зd-подуровень приобретает сразу два электрона, что обеспечивает его полное заполнение (3d10) и энергетический выигрыш. Поэтому электронная конфигурация атома меди ls22s22p63s23p63d104s1. В соединениях медь проявляет степень окисления +1 и +2. В ряду напряжений металлов она стоит после водорода и является малоактивным металлом, который кислоты могут окислять лишь за счет аниона:

или в присутствии дополнительного окислителя в среде:

Известны два оксида меди Сu2О и СuО. Гидроксид меди(1) неустойчив, и при попытке его получения реакцией обмена выделяется оксид меди(1), который проявляет основные свойства:

Оксид меди(2) и гидроксид меди(2) проявляют слабые амфотерные свойства с преобладанием основных свойств:

В нейтральных и кислых растворах катион Си2+ гидратирован с образованием окрашенного в голубой цвет аквакомплекса [Cu(H2O)6]2+, который довольно прочно удерживает молекулы воды (т = 3*10-8 с).
Катион Сu+ при повышенных температурах склонен к окислительно-восстановительной дисмутации:  Это равновесие может быть смещено в любом направлении в зависимости от природы лиганда.
Это равновесие может быть смещено в любом направлении в зависимости от природы лиганда.
 |
Катион Сu2+ - достаточно сильный окислитель, который может окислить альдегиды до карбоновых кислот, а некоторые тиолы до дисульфидов:
Катионы меди - сильные комплексообразователи по отношению к лигандам, содержащим карбоксильную (—СОО-), амино-(—NH2), циано- (—CN-) и особенно тиольную (—SH) группы, причем образуются комплексы нейтрального, катионного и анионного типа:

За счет реакции с тиольными группами белков катионы меди инактивируют ферменты и разрушают нативную конформацию белка. На этом основано их антимикробное действие:

Биологическое действие. Медь является необходимым микроэлементом растительных и животных организмов. Это связано со следующими ее особенностями. Во-первых, ионы меди по сравнению с ионами других металлов жизни активнее реагируют и образуют более устойчивые комплексы с аминокислотами и белками. Во-вторых, ионы меди служат исключительно эффективными катализаторами, особенно в сочетании с белками. В-третьих, медь легко переходит из одного валентного состояния в другое, что особенно благоприятствует ее метаболическим функциям. Например, при активации молекулы кислорода в реакциях окисления органических соединений.
 |
Медьсодержащие ферменты окисления оксигеназы [ОКГСu+] присоединяют молекулу кислорода с образованием пероксидной цепочки и окислением меди из Сu+ в Сu2+. Образовавшийся комплекс фермента с молекулой кислорода окисляет биосубстрат:
Важную физиологическую функцию выполняет фермент супероксиддисмутаза [СОДСu2+], ускоряя реакцию разложения супероксид-иона *О2(-), возникающего при свободнорадикальном окислении веществ в клетке (разд. 9.3.9). Этот радикал очень активно взаимодействует с разными компонентами клетки, разрушая их. Супероксиддисмутаза, взаимодействуя с супероксид-ионом *О2(-), превращает его в молекулярный кислород и в пероксид водорода, при этом атом меди фермента выступает и окислителем, и восстановителем:

Важную роль в дыхательной цепи играет фермент цитохром-оксидаза [Fе2+ЦХ0Сu+], которая кроме меди содержит еще и железо (разд. 10.4). Цитохромоксидаза катализирует перенос электронов от окисляемого вещества на молекулярный кислород. В ходе каталитического процесса степени окисления меди и железа обратимо изменяются, а восстанавливающийся кислород, присоединяя протоны, превращается в воду:

 |
Многопрофильную функцию в организме выполняет медьсодержащий белок плазмы крови - церулоплазмин [ЦПСu2+]. В церулоплазмине присутствует 98 % меди, имеющейся в плазме крови, и он выполняет не только роль резервуара для меди, но и транспортную функцию, регулируя баланс меди и обеспечивая выведение избытка меди из организма. Кроме того, церулоплазмин катализирует окисление Fe2+ в Fe3+, участвуя в кроветворении:
Восстановленная форма церулоплазмина подобно цитохромок-сидазе катализирует четырехэлектронное восстановление молекулярного кислорода в воду:

Медь вместе с железом участвует в кроветворении. Дефицит меди может привести к разрушению эритроцитов, а также нарушению остеогенеза с изменениями в скелете, аналогичными наблюдаемым при рахите.
 |
У моллюсков и членистоногих кислород переносится медьсодержащим белком гемоцианином [ГЦСu+]. В отличие от гемоглобина гемоцианин находится только в плазме, а не в клетках, и, кроме того, в процессе связывания и освобождения кислорода происходит окисление и восстановление меди в гемоцианине, что объясняет голубой цвет крови у этих организмов:
Возникшие в процессе эволюции высшие организмы для переноса кислорода используют гемоглобин, обеспечивающий более высокие концентрации кислорода в крови.
ЦИНК
В организме взрослого человека содержится 1,4-2,3 г цинка, из них 20 % - в костях, 65 % - в мышцах, 9 % - в крови, остальное - в печени и предстательной железе. Рекомендуемая ежедневная доза потребления составляет около 20 мг.
Цинк является d-металлом ПБ группы 4 периода периодической системы, его электронная формула ls22s22p63s23p63d104s2. Так как цинк имеет заполненный Зd-подуровень, то в образовании химических связей участвуют только два внешних 4s-электрона, и поэтому во всех соединениях цинк всегда проявляет степень окисления +2. Следовательно, в условиях организма для цинксодержащих биосубстратов окислительно-восстановительные превращения не имеют места, но для них характерны амфотерные и комплексообразующие свойства.
В кислых водных растворах катион Zn2+ образует акваком-плексы [Zn(H20)4]2+, в которых молекулы воды удерживаются довольно прочно (т = 5*10-7 с). Оксид и гидроксид цинка амфотерны и поэтому легко растворяются и в кислотах, и в щелочах:

С учетом большой склонности катионов цинка к комплек-сообразованию его амфотерность лучше выразить следующим равновесием:

Кислотные и основные свойства у гидроксида цинка выражены примерно одинаково с легким преобладанием основных свойств (рК1a = 7,8). Следовательно, в водных средах, близких к нейтральным (5,8 < рН < 9,8), в растворе будет иметь место указанное равновесие между комплексными ионами цинка, что следует учитывать при описании механизма действия цинксодержащих ферментов:
 |
Цинк входит в состав более 40 металлоферментов. Так, установлено, что он входит в состав активного центра карбоан-гидразы, карбоксипептидазы, РНК- и ДНК-полимераз, супероксиддисмутазы и других.
 |
Присутствие цинка в эритроцитах объясняется тем, что он содержится в карбоангидразе. Карбоангидраза катализирует процессы гидратации СO2 и дегидратации угольной кислоты, тем самым влияет на процесс дыхания, на его скорость и на газообмен в организме:
В карбоангидразе цинк с белком, содержащим 260 аминокислотных остатков, образует три донорно-акцепторные связи, а четвертая связь удерживает или молекулу воды, или гидроксильную группу. Соотношение этих форм зависит от рН среды. Механизм гидратации СО2 в активном центре карбоангидразы для этих случаев можно представить следующими схемами:
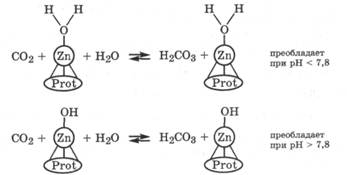
Подобный механизм действия, включающий две формы фермента, имеет место и в случае фермента карбоксипептидазы, катализирующего гидролиз пептидных связей.
Известное влияние оказывает цинк на углеводный обмен. Полагают, что благоприятное для организма больного диабетом влияние (удлинение гипогликемического эффекта), вызванное взаимодействием цинка с инсулином, заключается не только в стабилизирующем воздействии цинка на молекулу инсулина, но и в угнетении цинком процесса разрушения инсулина в тканях под действием фермента инсулиназы.
Цинк активирует биосинтез витаминов С и В. Установлено стимулирующее его действие на фагоцитарную активность лейкоцитов.
Дата публикования: 2014-10-16; Прочитано: 3385 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
