 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Условия смещения ионного гетерогенного равновесия
|
|
Смещение ионных гетерогенных равновесий происходит в соответствии с принципом Ле Шателье в направлении наиболее полного связывания ионов. Изменение концентрации ионов (особенно одноименных) в растворе малорастворимого электролита приводит к значительному изменению его растворимости, при этом константа гетерогенного равновесия - константа растворимости Ks - остается постоянной. Из этой закономерности вытекают следующие четыре правила, описывающие: образование осадка; растворение осадка; последовательность осаждения ионов; достижение полноты осаждения ионов.
Образование осадка. Осадок малорастворимого электролита KtnAnm выпадает из пересыщенного раствора.
Осадок малорастворимого сильного электролита образуется, если стехиометрическое произведение концентраций его ионов в растворе станет больше константы растворимости, т. е. 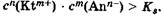
Выпадение осадка продолжается до тех пор, пока раствор не станет насыщенным. В некоторых случаях кристаллизация малорастворимого электролита, ограничивается только возникновением его микрокристаллов, которые стабилизируются, и при этом образуется лиофобный коллоидный ультрамикрогетерогенный раствор (разд. 27.2.1).
Растворение осадка. Осадок малорастворимого электролита KtnAnm начнет растворяться в том случае, если раствор над ним станет ненасыщенным.
Осадок малорастворимого сильного электролита растворяется, если в растворе над осадком этого малорастворимого электролита создать условия, при которых стехиометрическое произведение концентраций ионов станет меньше его константы растворимости, т. е. cn(Ktm+) • cm(An-n) < Ks. Создать условия для растворения осадка малорастворимого электролита можно за счет химического связывания хотя бы одного из его ионов в растворе, которое будет более полным, чем в осадке. Рассмотрим типичные случаи растворения осадка.

Растворение Mg(OH)2 в кислоте происходит из-за более прочного связывания ионов ОН- в молекуле Н20, чем они были связаны в осадке Mg(OH)2.
 |
При добавлении кислоты ионы С03(-2), посылаемые в раствор осадком СаС03, образуют слабую и неустойчивую кислоту Н2С03, которая разлагается, и при этом С02 удаляется из сферы реакции, что приводит к растворению СаС03.

Осадок AgCl растворяется в водном растворе аммиака, так как, взаимодействуя с аммиаком, образует водорастворимый комплекс [Ag(NH3)2]Cl, устойчивый при избытке аммиака в растворе.
Растворение осадков может происходить в результате изменения степени окисления какого-либо элемента, входящего в состав осадка:
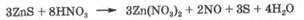
Таким образом, химические реакции, лежащие в основе растворения осадков, могут быть кислотно-основными, комплексообразования и окислительно-восстановительными. Растворение осадка является результатом конкуренции между гетерогенным равновесием, имеющим физико-химический характер, и химическими равновесиями, в основе которых лежат указанные реакции. Конкуренцию выигрывает то равновесие, которое приводит к более полному связыванию хотя бы одного из общих ионов, участвующих в этих равновесиях. Количественные рас четы, связанные с положением тех или иных равновесий, проводят, используя величины констант соответствующих равновесий и концентраций ионов в растворе, участвующих в этиз равновесиях.
Дата публикования: 2014-10-16; Прочитано: 4872 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
