 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Влияние общего иона и противоиона на равновесие
|
|
Если к водному раствору слабого электролита добавить сильный электролит, содержащий общий ион, то в соответствии с принципом Ле Шателье равновесная система будет уменьшать это воздействие, смещая равновесие в сторону недиссоциированной формы, т. е. понижать степень диссоциации. Так, при добавлении к водному раствору слабой кислоты, например уксусной, какой-либо сильной кислоты в системе создается избыток катионов Н+, который способствует ассоциации ионов Н+ и СНзСОО- и препятствует диссоциации СН3СООН. Аналогичное действие вызовет добавление в систему соли ацетата натрия (вследствие создания избытка иона ацетата). Таким образом, добавление одноименного иона уменьшает степень диссоциации слабого электролита, но при этом значение его константы диссоциации сохраняется. При добавлении в равновесную систему противоиона, т. е. иона, который прочно связывает один из ионов электролита в новое соединение, электролитическая диссоциация слабого электролита усилится, а концентрация его недиссоциированных молекул в растворе уменьшится. Для катиона Н+ противоионом является анион ОН- (и наоборот), так как при их взаимодействии образуется Н2О. Для анионов кислот противоионами являются катионы металлов, которые с этими анионами образуют малорастворимые соли.
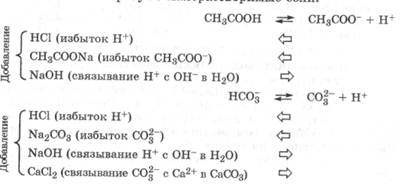 |
Влияние общего иона и противоиона на процесс электролитической диссоциации электролитов носит общий характер, и это можно использовать для любых обратимых систем.
Дата публикования: 2014-10-16; Прочитано: 3949 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
