 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Равновесие в растворах слабых электролитов
|
|
Электролитическая диссоциация слабых электролитов - процесс обратимый в связи с тем, что в их растворах одновременно имеются и недиссоциированные молекулы и ионы. Следовательно, в растворах слабых электролитов всегда имеет место химическое равновесие, выражающееся в равенстве скоростей реакции диссоциации  и ассоциации
и ассоциации 


Скорости диссоциации и ассоциации в водных растворах очень велики, поэтому электролитическое равновесие в растворах слабых электролитов устанавливается очень быстро 
Используя закон действующих масс, электролитическое равновесие в растворах слабых электролитов можно количественно выразить величиной константы диссоциации. В случае слабых кислот эта величина обозначается Ка (acid), в случае слабых оснований - Kb, (base):
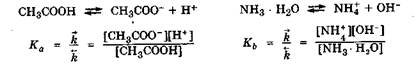
Значение константы диссоциации как константы истинного равновесия не зависит от концентрации слабого электролита в растворе, но зависит от следующих факторов:
- природы вещества (табл. 7.1);
- природы растворителя (с увеличением 777s константа диссоциации возрастает);
- температуры (при повышении температуры константа диссоциации увеличивается).

Значения констант диссоциации слабых электролитов много меньше единицы (см. табл. 7.1), и поэтому вместо констант диссоциации принято использовать показатели этих величин рКа или рКь: рКа — -lg Ка и рКb = -lg Кb. Чем меньше значение рКа электролита (в этом случае значение его константы диссоциации больше), тем больше это вещество распадается на ионы и тем сильнее электролит.
Электролитическая диссоциация многоосновных кислот (Н3РО4, Н2С03) и многокислотных оснований (Fe(OH)3) протекает ступенчато. При этом первая ступень протекает в значительно большей степени, чем последующие

В соответствии со сказанным ступенчатая равновесная диссоциация всегда характеризуется значениями констант диссоциации, уменьшающимися в следующей последовательности:

Дата публикования: 2014-10-16; Прочитано: 7513 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
