 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Особенности растворов сильных электролитов. Ионная сила раствора
|
|
В водных растворах сильные электролиты (например, НСl, NaCl, КОН) полностью диссоциированы, причем гидратированные ионы, образующиеся при их диссоциации, обычно не ассоциируются в молекулы. Поэтому в уравнении электролитической диссоциации сильных электролитов знак обратимости 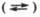 следует заменить знаком односторонней направленности процесса (—>):
следует заменить знаком односторонней направленности процесса (—>):

Процесс электролитической диссоциации сильного электролита, в отличие от диссоциации слабого электролита, нельзя охарактеризовать константой диссоциации, так как этот процесс практически необратим, что приводит к зависимости значения константы диссоциации от концентрации раствора. Вследствие полной диссоциации число ионов в растворе сильных электролитов всегда значительно больше, чем в растворах слабых электролитов той же концентрации. В концентрированных растворах сильных электролитов ионы расположены близко друг к другу и поэтому сильно взаимодействуют между собой. Значительное межионное взаимодействие приводит к тому, что ионы в растворах не вполне свободны, а их движение затруднено. Снижение подвижности ионов уменьшает степень их участия в процессах, протекающих в растворе, создавая эффект уменьшения их концентрации. Количественно влияние межионного взаимодействия на поведение иона Xi в растворе сильного электролита характеризуется его активностью a(Xi) и коэффициентом активности у(Хi;).
Активность иона a(Xi) - эффективная концентрация иона Xi, соответственно которой он участвует во взаимодействиях, протекающих в растворах сильных электролитов.
Коэффициент активности иона y(Xi) показывает, во сколько раз активность иона отличается от его истинной концентрации в растворе сильного электролита.
Активность иона связана с его молярной концентрацией уравнением: а(Хi) = у(Хi;) c(Xi).
В бесконечно разбавленных растворах (с < 10-4 моль/л), где концентрации ионов малы и межионное взаимодействие практически отсутствует, у(Хi) = 1 и активности ионов очень близки их молярным концентрациям: a(Xi) = c(Xi).
Значение коэффициента активности иона зависит от: 1) концентрации этого иона; 2) температуры; 3) концентрации других ионов.
1. При переходе от бесконечно разбавленных растворов, где y(X) = 1, к более концентрированным у(Хi) вначале уменьшается (у(Хi) < 1) из-за увеличения межионного взаимодействия, а при концентрации раствора, близкой к 1 моль/л и выше, значение у(Хi,) начинает возрастать и может даже превысить 1, т. е. активность иона в растворе становится больше его истинной концентрации. Это объясняется тем, что в растворах с высокой концентрацией ионов не хватает воды для полной их гидратации, что резко увеличивает подвижность ионов, так как они конкурируют между собой за молекулы воды.
2. С повышением температуры у(Хi;) увеличивается, так как возрастает подвижность иона не только за счет увеличения скорости движения всех частиц в растворе, но и в результате частичного разрушения гидратного слоя вокруг него.
3. На величину y(Xi) влияет общая концентрация всех ионов в растворе. В связи с этим Г. Льюис (1907) ввел понятие ионной силы раствора электролита.
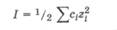 |
Ионная сила раствора - величина, характеризующая интенсивность электростатического поля всех ионов в растворе, которая равна полусумме произведений молярной концентрации (ci) каждого иона на квадрат его заряда (zi):
Определим взаимосвязь между ионной силой раствора электролита и его концентрацией в зависимости от числа и заряда ионов в молекуле электролита. Так, для электролита с однозарядными ионами, например NaCl 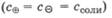
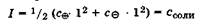
Для электролита, содержащего двух- и трехзарядные ионы, например Al2(S04)3 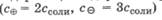

Следовательно, ионная сила раствора сильно возрастает при наличии в нем многозарядных ионов.
В очень разбавленных растворах зависимость между коэффициентом активности иона уi, зарядом этого иона zi и ионной силой I описывается уравнением Дебая - Хюккеля:

Из этого соотношения следует, что с увеличением ионной силы раствора коэффициент активности данного иона уменьшается. На практике значения коэффициентов активности ионов в растворах данной концентрации берут из справочных таблиц.
В биологических системах широко распространены межионные взаимодействия, которые сильно зависят от ионной силы растворов, что прежде всего сказывается на значениях констант диссоциации ионогенных групп биологических субстратов, так как они определяются активностями ионов, а не их концентрациями. Незначительное увеличение ионной силы раствора вызывает изменение степени ионизованности белков или нуклеиновых кислот, вследствие чего меняется их конформация, а следовательно, и биологические функции. Поэтому при использовании растворов электролитов в биологических экспериментах крайне необходимо, чтобы их ионная сила была равна ионной силе соответствующей биологической системы. Так, ионная сила плазмы крови человека равна 0,15 М, поэтому физиологический раствор -простейший заменитель плазмы крови - должен иметь соответствующую концентрацию NaCl (0,15 М, или 0,9 %).
Таким образом, ионная сила биологических систем, обусловленная содержанием в них сильных электролитов, влияет не только на химическую активность ионов, но и на биологическую функцию белков и нуклеиновых кислот, содержащихся в этих системах, что имеет большое значение в практической медицине.
При значительном увеличении ионной силы раствора в нем уменьшается количество свободной воды, не участвующей в гидратации ионов. Другими словами, уменьшается активность воды,  участвующей в процессе гидратации растворенных частиц. Это обстоятельство чрезвычайно важно для биологических систем, так как оно приводит к дегидратации природных полиэлектролитов (белков и нуклеиновых кислот), в результате чего вначале изменяется их конформация, а затем происходит даже их высаливание, т. е. выделение белков и нуклеиновых кислот из этих растворов. Влияние ионной силы раствора на растворимость полиэлектролитов имеет большое значение при проведении биохимического эксперимента. Добавление к биологическим жидкостям солей позволяет не только выделить белки и нуклеиновые кислоты, но и фракционировать их по молекулярной массе. При постепенном увеличении ионной силы раствора из него вначале выделяются полиэлектролиты с большей молекулярной массой и меньшей гидрофильностью. Для выделения полиэлектролитов с меньшей молекулярной массой и с большей гидрофильностью требуется создать в растворе более высокую ионную силу. При выделении природных полимеров из биологических сред наибольшее высаливающее действие проявляют анионы солей, так как структура их гидратной оболочки ближе к структуре гидратной оболочки белков и нуклеиновых кислот, чем катионов (см. разд. 6.1). Чем больше заряд аниона и меньше его размер, тем сильнее он гидратируется и тем выше его дегидратирующая способность по отношению к полиэлектролитам. По высаливающему действию анионы могут быть расположены в следующий ряд:
участвующей в процессе гидратации растворенных частиц. Это обстоятельство чрезвычайно важно для биологических систем, так как оно приводит к дегидратации природных полиэлектролитов (белков и нуклеиновых кислот), в результате чего вначале изменяется их конформация, а затем происходит даже их высаливание, т. е. выделение белков и нуклеиновых кислот из этих растворов. Влияние ионной силы раствора на растворимость полиэлектролитов имеет большое значение при проведении биохимического эксперимента. Добавление к биологическим жидкостям солей позволяет не только выделить белки и нуклеиновые кислоты, но и фракционировать их по молекулярной массе. При постепенном увеличении ионной силы раствора из него вначале выделяются полиэлектролиты с большей молекулярной массой и меньшей гидрофильностью. Для выделения полиэлектролитов с меньшей молекулярной массой и с большей гидрофильностью требуется создать в растворе более высокую ионную силу. При выделении природных полимеров из биологических сред наибольшее высаливающее действие проявляют анионы солей, так как структура их гидратной оболочки ближе к структуре гидратной оболочки белков и нуклеиновых кислот, чем катионов (см. разд. 6.1). Чем больше заряд аниона и меньше его размер, тем сильнее он гидратируется и тем выше его дегидратирующая способность по отношению к полиэлектролитам. По высаливающему действию анионы могут быть расположены в следующий ряд: 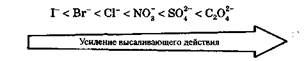
На практике для выделения белков обычно используют сульфат аммония (NH4)2S04. Например, для выделения из крови фибриногена (М = 340 000) требуется ионная сила 2,9, гемоглобина (М = 64 450) - 5,8, а миоглобина (М = 17 800) - 9,6.
Дата публикования: 2014-10-16; Прочитано: 11678 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
