 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Осмос. Осмотическое и онкотическое давление
|
|
Рассмотрим случай, когда на пути диффузии частиц растворенного вещества и растворителя находится мембрана с избирательной проницаемостью, через которую свободно проходят молекулы растворителя, а молекулы растворенного вещества практически не проходят. Лучшей избирательной проницаемостью обладают мембраны, изготовленные из природных тканей животного и растительного происхождения (стенки кишок и мочевого пузыря, различные растительные ткани).
Осмосом называется самопроизвольная диффузия молекул растворителя сквозь мембрану с избирательной проницаемостью.

 |
- болышей площади поверхности мембраны, свободной от частиц растворенного вещества со стороны чистого растворителя s1, чем со стороны раствора s2, где часть поверхности мембраны занята частицами растворенного вещества, т. е. s1 > s2;
Рис. 6.7. Осмос в системе растворитель — раствор, разделенные мембраной с избирательной проницаемостью
- большей подвижности молекул растворителя в чистом растворителе, чем в растворе, где есть межмолекулярное взаимодействие между веществом и растворителем, уменьшающее подвижность молекул растворителя.
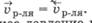 |
Из-за этих различий через некоторое время, вследствие уменьшения разности концентрации растворителя в разделенных частях системы и появления избыточного гидростатического давления со стороны раствора, скорость диффузии растворителя будут изменяться по-разному:
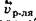 - уменьшаться, а
- уменьшаться, а  - увеличиваться. Это обстоятельство обязательно приведет к наступлению в системе состояния динамического физико-химического равновесия, характеризующегося равенством скоростей диффузии молекул растворителя через мембрану
- увеличиваться. Это обстоятельство обязательно приведет к наступлению в системе состояния динамического физико-химического равновесия, характеризующегося равенством скоростей диффузии молекул растворителя через мембрану
Появляющееся избыточное гидростатические дшишпис в системе является следствием осмоса, поэтому это давление называется осмотическим.
Осмотическим давлением ( 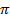 ) называют избыточное гидростатическое давление, возникающее в результате осмоса и приводящее к выравниванию скоростей взаимного проникновения молекул растворителя сквозь мембрану с избирательной проницаемостью.
) называют избыточное гидростатическое давление, возникающее в результате осмоса и приводящее к выравниванию скоростей взаимного проникновения молекул растворителя сквозь мембрану с избирательной проницаемостью.
В. Пфеффер и Я. Вант-Гофф, изучая количественную зависимость осмотического давления от внешних факторов, установили, что оно подчиняется объединенному газовому закону Менделеева - Клапейрона:

где с - молярная концентрация вещества в растворе, моль/л.
Из этого уравнения видно, что осмотическое давление не зависит от природы растворенного вещества, а зависит только от числа частиц в растворе и от температуры. Однако это уравнение справедливо только для растворов, в которых отсутствует взаимодействие частиц, т. е. для идеальных растворов. В реальных растворах имеют место межмолекулярные взаимодействия между молекулами вещества и растворителя, которые могут приводить или к диссоциации молекул растворенного вещества на ионы, или к ассоциации молекул растворенного вещества с образованием из них ассоциатов.
Диссоциация молекул вещества в водном растворе характерна для электролитов (см. разд. 7.1). В результате диссоциации число частиц в растворе увеличивается.
Ассоциация наблюдается, если молекулы вещества лучше взаимодействуют между собой, чем с молекулами растворителя. В результате ассоциации число частиц в растворе уменьшается.
Для учета межмолекулярных взаимодействий в реальных растворах Вант-Гофф предложил использовать изотонический коэффициент l. Для молекул растворенного вещества физический смысл изотонического коэффициента:
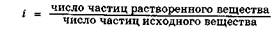
Для растворов неэлектролитов, молекулы которых не диссоциируют и мало склонны к ассоциации, i = 1.
Для водных растворов электролитов вследствие диссоциации i > 1, причем максимальное его значение (lmax) для данного электролита равно числу ионов в его молекуле:

Для растворов, в которых вещество находится в виде ассоциатов, i < 1, что характерно для коллоидных растворов. Для растворов белков и высокомолекулярных веществ величина i зависит от концентрации и природы этих веществ (разд. 27.3.1).
С учетом межмолекулярных взаимодействий осмотическое давление для реальных растворов равно:

Это уравнение правильно отражает наблюдаемое в эксперименте осмотическое давление растворов с одинаковой массовой долей вещества, но с различной природой и состоянием растворенного вещества в растворе (табл. 6.2).

При осмосе молекулы растворителя преимущественно движутся через мембрану в том направлении, где концентрация частиц вещества больше, а концентрация растворителя меньше. Другими словами, в результате осмоса происходит всасывание растворителя в ту часть системы, где концентрация частиц вещества больше. Если осмотическое давление у растворов одинаковое, то они называются изотоническими и между ними происходит подлинно равновесный обмен растворителем. В случае контакта двух растворов с разным осмотическим давлением гипертоническим раствором называется тот, у которого осмотическое давление больше, а гипотоническим — раствор с меньшим осмотическим давлением. Гипертонический раствор всасывает растворитель из гипотонического раствора, стремясь выровнять концентрации вещества путем перераспределения растворителя между контактирующими растворами.
Осмотическая ячейка - это система, отделенная от окружающей среды мембраной с избирательной проницаемостью. Все клетки живых существ являются осмотическими ячейками, которые способны всасывать растворитель из окружающей среды или, наоборот, его отдавать, в зависимости от концентраций растворов, разделенных мембраной.

В результате эндоосмоса вода диффундирует в клетку, происходит набухание клетки с появлением напряженного состояния клетки, называемого тургор. В растительном мире тургор помогает растению сохранять вертикальное положение и определенную форму.
 |
Если разница в концентрациях наружного и внутреннего раствора достаточно велика, а прочность оболочки клетки небольшая, то эндоосмос приводит к разрушению клеточной мембраны и лизису клетки. Именно эндоосмос является причиной гемолиза эритроцитов крови с выделением гемоглобина в плазму (см. рис. 6.9). Эндоосмос происходит, если клетка оказывается в гипотоническом растворе.
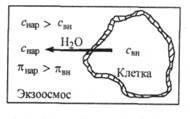
Экзоосмос — движение растворителя из осмотической ячейки в окружающую среду. Условие экзоосмоса:
 |
В результате экзоосмоса вода диффундирует из клетки в плазму и происходит сжатие и сморщивание оболочки клетки, называемое плазмолизом. Экзоосмос имеет место, если клетка оказывается в гипертонической среде. Явление экзоосмоса наблюдается, например, при посыпании ягод или фруктов сахаром, а овощей, мяса или рыбы - солью. При этом происходит консервирование продуктов питания благодаря уничтожению микроорганизмов вследствие их плазмолиза.
При приготовлении физиологических растворов необходимо учитывать их осмотические свойства, поэтому их концентрацию выражают через осмолярную концентрацию (осмолярность) (см. Приложение 1).
Осмолярная концентрация - суммарное молярное количество всех кинетически активных, т. е. способных к самостоятельному движению, частиц, содержащихся в 1 литре раствора, независимо от их формы, размера и природы.
Осмолярная концентрация раствора связана с его молярной концентрацией через изотонический коэффициент с = ic(X).
Роль осмоса в биологии и медицине. Осмос является одной из причин, обуславливающих поступление воды и растворенных в ней веществ из почвы по стеблю или стволу растения к листьям, так как  . Осмотическое давление растительных клеток колеблется от 5 до 20 ат, а у растений пустынь достигает даже 70 ат.
. Осмотическое давление растительных клеток колеблется от 5 до 20 ат, а у растений пустынь достигает даже 70 ат.
Особенностью высших животных и человека является постоянство осмотического давления во многих физиологических системах, и прежде всего в системе кровообращения. Постоянство осмотического давления называется изоосмией. Осмотическое давление человека довольно постоянно и составляет 740-780 кПа (7,4-7,8 ат) при 37 °С. Оно обусловлено главным образом присутствием в крови катионов и анионов неорганических солей и в меньшей степени - наличием коллоидных частиц и белков. Присутствие в плазме крови форменных элементов (эритроцитов, лейкоцитов, тромбоцитов и кровяных пластинок) почти не влияет на осмотическое давление. Постоянство осмотического давления в крови регулируется выделением паров воды при дыхании, работой почек, выделением пота и т. Д.
 |
Рис. 6.8. Роль онкотического давления крови в капиллярном обмене воды
Осмотическое давление крови, создаваемое за счет белков плазмы крови, называемое онкотическим давлением, хотя и составляет величину порядка 2,5-4,0 кПа, но играет исключительно важную роль в обмене водой между кровью и тканями, в распределении ее между сосудистым руслом и внесосудистым пространством.
Онкотическое давление - это осмотичекое давление, создаваемое за счет наличия белков в биожидкостях организма.
Онкотическое давление крови составляет 0,5 % суммарного осмотического давления плазмы крови, но его величина соизмерима с гидростатическим давлением в кровеносной системе (рис. 6.8).
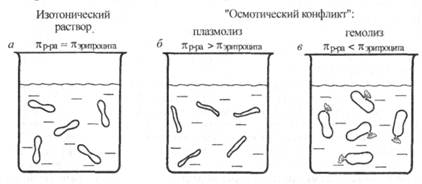
Рис. 6.9. Изменение эритроцита в растворах с различным осмотическим давлением 77пр_ра:
а - изотонический раствор (0,9 % NaCl); б - гипертонический раствор (2 % NaCl); в - гипотонический раствор (0,1 % NaCl)
Гидростатическое давление крови падает от артериальной части кровеносной системы к венозной. Если в артериальной части капилляров гидростатическое давление больше онкотического давления, то в венозной - меньше. Это обеспечивает перемещение воды из артериальных капилляров в межклеточную жидкость тканей, а венозные капилляры, наоборот, втягивают межклеточную жидкость. Причем интенсивность такого переноса воды прямо пропорциональна разности между Ргидр и  онк.
онк.
При понижении онкотического давления крови, которое наблюдается при гипопротеинемии (понижение содержания белка в плазме), вызванной голоданием, нарушением пищеварения или выделением белка с мочой при болезни почек, указанное соотношение давлений ргидр и 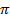 0HK нарушается. Это приводит к перераспределению жидкости в сторону тканей, и в результате возникают онкотпические отеки ("голодные" или "почечные").
0HK нарушается. Это приводит к перераспределению жидкости в сторону тканей, и в результате возникают онкотпические отеки ("голодные" или "почечные").
Осмотическому давлению крови человека соответствует осмо-лярная концентрация частиц от 290 до 300 мОсм/л. В медицинской и фармацевтической практике изотоническими (физиологическими) растворами называют растворы, характеризующиеся таким же осмотическим давлением, как и плазма крови (рис. 6.9, а). Такими растворами являются 0,9 % раствор NaCl (0,15 моль/л), в котором i = 2, и 5 % раствор глюкозы (0,3 моль/л). Во всех случаях, когда в кровяное русло, мышечную ткань, спинномозговой канал и т. д. с терапевтическими целями вводят растворы, необходимо помнить о том, чтобы эта процедура не привела к "осмотическому конфликту" из-за различия осмотических давлений вводимого раствора и данной системы организма. Если, например, внутривенно ввести раствор, гипертонический по отношению к крови, то вследствие экзоосмоса эритроциты будут обезвоживаться и сморщиваться - плазмолиз (рис. 6.9, б). Если же вводимый раствор гипотоничен по отношению к крови, то наблюдается "осмотический шок" и вследствие эндоосмоса может произойти разрыв эритроцитарных оболочек - гемолиз (рис. 6.9, в). Начальная стадия гемолиза происходит при местном снижении осмотического давления до 360-400 кПа (3,5-3,9 ат), а полный гемолиз - при 260-300 кПа (2,5-3,0 ат).
Изменение осмотического равновесия в биосистемах организма может быть вызвано нарушением обмена веществ, секреторными процессами и поступлением пищи. Кроме того, всякое физическое напряжение, усиливающее обмен веществ, может способствовать повышению осмотического давления крови. Несмотря на эти нарушения, осмотическое давление крови поддерживается постоянным, хотя химический состав крови может значительно изменяться. При возникновении осмотической гипертонии крови соединительная ткань, находящаяся в месте нарушения, отдает в кровь воду и забирает из нее соли почти сразу и до тех пор, пока осмотическое давление крови или тканевой жидкости не возвратится к нормальному значению. После этой быстрой реакции включаются почки, которые отвечают на увеличение количества каких-либо солей повышенным их выделением, пока не будет восстановлен нормальный состав соединительной ткани и крови. Осмотическое давление мочи, сохраняя норму, может изменяться в пределах от 7,0 до 25 ат (690-2400 кПа). Подобная регуляция имеет определенные границы, и поэтому для ее усиления может потребоваться поступление воды или солей извне. Здесь вступает в действие вегетативная нервная система. Чувство жажды после физической работы (повышенный обмен веществ) или при почечной недостаточности (накопление веществ в крови из-за недостаточного их выделения) - это проявление осмотической гипертонии. Обратное явление наблюдается в случае солевого голода, вызывающего осмотическую гипотонию.
Воспаление возникает в результате резкого местного усиления обмена веществ. Причиной воспаления могут быть различные воздействия - химические, механические, термические, инфекционные и радиационные. Вследствие повышенного местного обмена веществ усиливается распад макромолекул на более мелкие молекулы, что увеличивает концентрацию частиц в очаге воспаления. Это приводит к местному повышению осмотического давления, выделению в очаг воспаления большого количества жидкости из окружающих тканей и образованию экссудата. В медицинской практике используют гипертонические растворы или марлевые повязки, смоченные гипертоническим раствором NaCl, который в соответствии с закономерностями осмоса всасывает жидкость в себя, что способствует постоянному очищению раны от гноя или устранению отека. В некоторых случаях для этих же целей используют этиловый спирт или его концентрированные водные растворы, которые гипертоничны относительно живых тканей. На этом основано их дезинфицирующее действие, так как они способствуют плазмолизу бактерий и микроорганизмов.
Действие слабительных средств - горькой соли MgS04 • 7Н2О и глауберовой соли Na2S04 • 10Н2О также основано на явлении осмоса. Эти соли плохо всасываются через стенки кишечника, поэтому они создают в нем гипертоническую среду и вызывают поступление в кишечник большого количества воды через его стенки, что приводит к послабляющему действию. Следует иметь в виду, что распределение и перераспределение воды в организме происходит и по другим более специфическим механизмам, но осмос
 |
играет в этих процессах ведущую роль, а значит, он играет ведущую роль и в поддержании гомеостаза.
Дата публикования: 2014-10-16; Прочитано: 7665 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
