 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Химическое равновесие. Химические реакции бывают необратимые и обратимые.
|
|
Химические реакции бывают необратимые и обратимые.
Необратимыми называются реакции, которые протекают только в одном направлении до полного израсходования одного из реагирующих веществ.
Необратимыми являются, например, взаимодействие активных металлов с кислородом, водой, кислотой или термическое разложение сложных веществ:
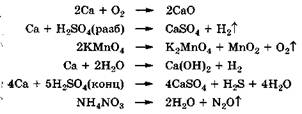
Однако в природе необратимых реакций меньше, чем обратимых, которые лучше называть обратимыми процессами.
| « |
Обратимыми называются процессы, в которых одновременно протекают две взаимно противоположные реакции - прямая и обратная.
Примером обратимых процессов являются реакции образования и разложения иодоводорода или сложного эфира:
 |
В таких химических системах при определенных условиях одновременно протекают как прямая, так и обратная реакция. При этом в результате каждой реакции образуются исходные вещества, необходимые для осуществления противоположной реакции, причем уменьшение скорости одной реакции сопровождается увеличением скорости обратной реакции до тех пор, пока скорости обеих реакций не станут равными (рис. 5.6). Следовательно, в этих случаях в системе без каких-либо внешних воздействий происходят взаимообратные химические превращения, которые приводят систему в устойчивое равновесное состояние, характеризующееся равенством скоростей прямой и обратной реакции 
Химическим равновесием называется такое состояние обратимого процесса, при котором скорости прямой и обратной реакций равны.
 |
Рис. 5.6. Изменение скорости прямой V и обратной V реакций в процессе установления химического равновесия
Состояние химического равновесия в любой системе характеризуется постоянством параметров, описывающих эту систему (разд. 4.6). Поэтому в системе, где протекает обратимый процесс, в состоянии химического равновесия наблюдается не только равенство скоростей взаимно противоположных реакций, но и постоянство равновесных концентраций исходных и конечных веществ.
Равновесными концентрациями называются концентрации всех веществ системы, которые устанавливаются в ней при наступлении состояния химического равновесия.
Равновесные концентрации веществ, выраженные в моль/л, принято обозначать квадратными скобками, между которыми указывается формула вещества. Так, для приведенных выше процессов следует представлять исходные концентрации:

а равновесные концентрации:
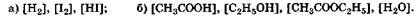
Состояние химического равновесия имеет следующие особенности:
1. Динамический характер химического равновесия - пря
мая и обратная реакции не прекращаются, а протекают с равными скоростями.
2. Постоянство состояния химического равновесия во времени - при неизменных внешних условиях состав равновесной
системы не меняется (равновесные концентрации постоянны).
3. Подвижность равновесия - при изменении внешних условий происходит смещение химического равновесия, т. е. установление новых равновесных концентраций всех реагирующих веществ.
4. Возможность подхода к состоянию равновесия с двух сторон - как со стороны исходных веществ, так и со стороны продуктов реакции.
В равновесной химической системе фактически нет ни реагентов, ни продуктов, так как все вещества и процессы их взаимодействия участвуют в создании равновесия. В таких системах вещества называются реагентами и продуктами только формально в соответствии с уравнением химической реакции.
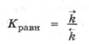 |
С учетом того, что в основе химического равновесия лежит равенство скоростей прямой и обратной реакций, для количественной характеристики состояния химического равновесия в системе можно ввести новый безразмерный параметр - константу химического равновесия, которая равна отношению константы скорости прямой реакции к константе скорости обратной реакции:
Выведем, чему равна Кравн процесса, протекающего в гомогенной системе: 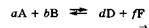
В состоянии химического равновесия v = v
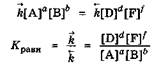
Константа химического равновесия обратимого процесса равна отношению произведения равновесных концентраций конечных продуктов к произведению равновесных концентраций исходных веществ, возведенных в степени, равные стехиометрическим коэффициентам при формулах соответствующих веществ в уравнении химической реакции.
Так формулируется закон действующих масс для обратимых процессов.
Концентрации твердых веществ в гетерогенных системах не входят в выражение константы химического равновесия, так как они учитываются величинами константы скорости гетерогенной реакции: 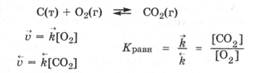
Значение константы химического равновесия определяет положение равновесия, т. е. относительное содержание исходных веществ и конечных продуктов в системе, находящейся в равновесном состоянии.
Если Kpaвн > 1, то в системе выше содержание конечных продуктов, т. е. положение равновесия смещено вправо (->).
Если Kравн < 1, то в системе выше содержание исходных веществ, т. е. положение равновесия смещено влево (<—).
Константа химического равновесия, как и константа скорости реакции, зависит от природы реагирующих веществ и температуры, но не зависит от присутствия катализатора, поскольку он изменяет константы скоростей и прямой и обратной реакции в одинаковое число раз (рис. 5.7). Катализатор, увеличивая скорости прямой и обратной реакций, уменьшает время, необходимое для установления равновесия в системе.
 |
Константа химического равновесия не зависит от концентраций реагирующих веществ и давления в системе, так как эти факторы не влияют на константы скоростей химических реакций.
Рис. 5.7. Установление химического равновесия без катализатора и с катализатором
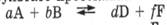 |
Рассмотрим равновесное состояние систем, в которых протекают обратимые процессы, с позиции второго начала термодинамики. Термодинамическим условием наступления равновесия в любой системе является равенство нулю изменения энергии Гиббса
 G = 0, а также отсутствие изменения и других параметров системы во времени. В состоянии равновесия энергия Гиббса системы имеет минимальное значение (G = min), вследствие чего состояние равновесия является для системы энергетически выгодным и устойчивым во времени (разд. 4.6).
G = 0, а также отсутствие изменения и других параметров системы во времени. В состоянии равновесия энергия Гиббса системы имеет минимальное значение (G = min), вследствие чего состояние равновесия является для системы энергетически выгодным и устойчивым во времени (разд. 4.6).
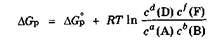 |
В результате протекания в системе обратимого химического процесса при изобарно-изотермических условиях изменение энергии Гиббса описывается уравнением изотермы реакции:
где AG° - изменение стандартной энергии Гиббса в ходе химического процесса при стандартных условиях.
При установлении в системе химического равновесия изменение энергии Гиббса равно нулю  , и концентрации всех реагирующих веществ становятся равновесными, а их соотношение - равным константе химического равновесия:
, и концентрации всех реагирующих веществ становятся равновесными, а их соотношение - равным константе химического равновесия:
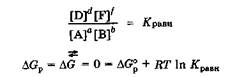
следовательно, 
Изменение стандартной энергии Гиббса при взаимодействии любых веществ можно рассчитать, используя табличные значения соответствующих термодинамических величин для реагирующих веществ и продуктов реакции.
Если 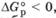 , то KpaBH > 1. Это означает, что в равновесной смеси преобладают продукты прямой реакции.
, то KpaBH > 1. Это означает, что в равновесной смеси преобладают продукты прямой реакции.
Если 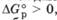 то Kравн < 1. Это означает, что в равновесной смеси преобладают исходные вещества.
то Kравн < 1. Это означает, что в равновесной смеси преобладают исходные вещества.
Таким образом, термодинамические расчеты позволяют теоретически определить состав равновесной смеси для обратимого процесса при заданных условиях.
Полученное соотношение между изменением стандартной энергии Гиббса обратимого химического процесса и константой его равновесия является универсальным. Это соотношение применимо к состоянию равновесия любого обратимого динамического процесса: химического взаимодействия, биохимических процессов, физико-химических процессов (растворение, фазовые переходы, осмос, диссоциация и электрохимические явления). Таким образом, термодинамика устанавливает соотношение между изменением стандартной энергии Гиббса в результате процесса, идущего в системе, и концентрациями участвующих компонентов в состоянии химического равновесия.
Дата публикования: 2014-10-16; Прочитано: 4602 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
