 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Влияние температуры. Энергия активации
|
|
Влияние температуры на скорость реакции отражено в правиле Вант-Гоффа.
С увеличением температуры на каждые 10 К скорость химической реакции возрастает в 2-4 раза:
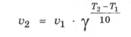
где у - температурный коэффициент скорости реакции, показывающий, во сколько раз увеличивается скорость реакции при увеличении температуры на каждые 10 К; v1, v2 - скорости реакции при температуре Т1 и Т2 соответственно.
Для обычных химических реакций у = 2-4, а для ферментативных реакций температурный коэффициент может достигать значений у = 7-9. Именно поэтому колебания температуры тела человека в пределах даже 1°С сильно сказываются на его самочувствии.
Влияние температуры на скорость реакции связано с изменением константы скорости реакции, поэтому приведенное выше уравнение лучше представить так:
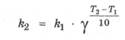
Сильное влияние температуры на скорость химической реакции объясняет теория активных столкновений. Основные постулаты этой теории:
—не каждое столкновение приводит к акту химического взаимодействия;
—к химическому взаимодействию приводят только те столкновения, в которых участвуют частицы, обладающие энергией, необходимой для данного взаимодействия (энергией активации);
—при соударении частицы должны быть определенным образом сориентированы относительно друг друга.
Энергия активации - это минимальная энергия взаимодействующих частиц, достаточная для того, чтобы все частицы вступили в химическую реакцию (Еа, кДж/моль).
 |
Энергия активации реакции характеризует энергетический барьер, преодоление которого реагирующими частицами приводит к образованию конечных веществ (рис. 5.4). Энергия активации необходима для возникновения непрочного переходного комплекса [А—В], который не является химическим соединением в подлинном смысле этого слова, так как в нем происходит перераспределение химических связей между взаимодействующими атомами. Такой промежуточный комплекс неустойчив вследствие его высокой энергии и может быстро распадаться, образуя продукты реакции D и F.
Рис. 5.4. Энергетический профиль течения реакции
Энергия активации зависит от природы реагирующих веществ и пути протекания реакции и не зависит от температуры, если с ее изменением не произошло изменения механизма реакции. Опытным путем установлено, что реакции с Еа < 50 кДж/моль при 298 К идут с высокой скоростью. Это характерно для реакций с участием радикалов или ионов. Если реакция имеет Еа > 100 кДж/моль, то ее скорость при 298 К неизмеримо мала.
Источники активации реагирующих веществ могут быть различными:
- термическая активация в результате подвода теплоты из окружающей среды;
- действие различного рода излучений (свет, проникающая радиация);
- действие быстрых частиц, возникающих при ядерном распаде или в электрическом разряде.
При подводе энергии к системе происходит перераспределение этой энергии между частицами и увеличивается доля активных частиц, имеющих необходимую энергию для данного взаимодействия.
Энергия активации является очень важной энергетической характеристикой реакции, которая связана с константой скорости реакции уравнением Аррениуса:
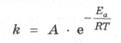
где k - константа скорости реакции при температуре Т; А — предэкспоненциальный коэффициент (коэффициент Аррениуса), учитывающий частоту столкновения частиц, ориентированных определенным образом; е -основание натурального логарифма; Еа - энергия активации реакции, Дж/моль; R = 8,31 Дж/(моль • К) - универсальная газовая постоянная.
Из этого уравнения следует, что чем больше энергия активации, тем меньше будут константа и скорость химической ре акции, так как в системе будет меньше число активных частиц. Если доля активных молекул превышает 10-7, то реакция идет практически мгновенно, а если эта доля меньше 10-18 - реакция при данных условиях практически не идет. При повышении температуры реакции за счет увеличения энергии системы резко возрастает число активных частиц, и этим объясняется значительное повышение скорости реакции.
Значение энергии активации реакции можно определить, измерив константы скорости этой реакции при двух разных температурах и используя следующее уравнение:

где k1 и k2 - константы скорости реакции при температуре Т1 и Т2.
Высокая энергия активации делает практически невозможными многие реакции, которые, с точки зрения термодинамики, могли бы происходить. Очень многие из окружающих нас веществ находятся в термодинамически неустойчивом состоянии, и только наличие барьера активации препятствует их превращению в другие вещества. Исчезни энергия активации, тогда азот, кислород воздуха и вода океанов образовали бы азотную кислоту, все живые ткани разрушились бы вследствие реакций гидролиза и т. д. Эта химическая хаотизация невероятна из-за существования энергии активации - характернейшей черты любых химических превращений. Молекула любого вещества потому и существует, что изменения ее состояния связаны с преодолением энергетического барьера, т. е. с энергией активации на пути ее превращений.
Дата публикования: 2014-10-16; Прочитано: 5778 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
