 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Ферментативный катализ и его особенности
|
|
Практически все биохимические реакции как у простейших одноклеточных, так и у растений и животных носят каталитический характер. В качестве катализаторов биохимических реакций выступают ферменты.
Ферменты (энзимы) - это белковые молекулы, которые катализируют химические реакции в живых системах.
Каталитической активностью обладает не вся молекула фермента, а лишь определенный ее участок, называемый активным центром. Субстрат, попадая в активный центр, активируется и претерпевает строго определенные химические превращения. Наряду с активным центром в структуре фермента имеется аллостерический центр, назначение которого узнавать субстрат и способствовать его размещению в активном центре.
Ферменты по химическому строению могут быть разделены на простые и сложные. У простых ферментов активный центр сформирован только белковой молекулой, а у сложных активный центр содержит небелковую составляющую, обеспечивающую каталитическую активность фермента. В сложных ферментах металло-протеинах (цитохромы, карбоангидраза, нитрогеназа, гемоглобин и др.) небелковая составляющая называется кофактором. Кофактор содержит катионы d-металлов, прочно (ковалентно) связанные с белком. В тех сложных ферментах, в которых небелковый фрагмент удерживается белком в основном за счет межмолекулярных взаимодействий и поэтому обычно слабо связан, он называется коферментом. Коферментами являются сложные органические соединения: НАД, ФАД, KoQ (разд. 9.3.3) и кофермент А(разд. 19.2.3).
В ряде случаев молекулы ферментов, катализирующие одну и ту же реакцию, но в разных тканях, имеют отличия в составе белкового компонента, тогда их называют изоферментами (изоэнзимами). Например, лактатдегидрогеназа, окисляющая молочную кислоту, состоит из 5 изоферментов. Изменение соотношения изо-ферментов в отдельных тканях и органах является одним из способов регуляции действия ферментов в организме.
Ферменты и их каталитическая активность характеризуются следующими специфическими свойствами.
Размер. Относительная молекулярная масса ферментов составляет от 105 до 107, это означает, что по размеру молекулы ферментов близки коллоидным частицам (гл. 27). Поэтому ферменты нельзя четко отнести ни к гомогенным, ни к гетерогенным катализаторам и их выделяют в самостоятельный класс ультрамикрогетерогенных катализаторов, имеющих активный и аллостерический центры.
Высокая каталитическая эффективность. Отличительной особенностью любого фермента является его чрезвычайно высокая каталитическая эффективность. Так, время полупревращения для реакции разложения мочевины при температуре 25 °С составляет 109 с, а в присутствии фермента уреазы оно снижается до 10~4 с, т. е. уменьшается в 1013 раз. Каталитическая активность ферментов во много раз превосходит активность обычных катализаторов. Например, 1 моль фермента алкогольдегидрогеназы за 1 с при температуре 25 °С способствует превращению 720 моль этанола в уксусный альдегид. Промышленный катализатор (1 моль) за 1 с даже при температуре 200 °С позволяет окислить только 1 моль этанола.
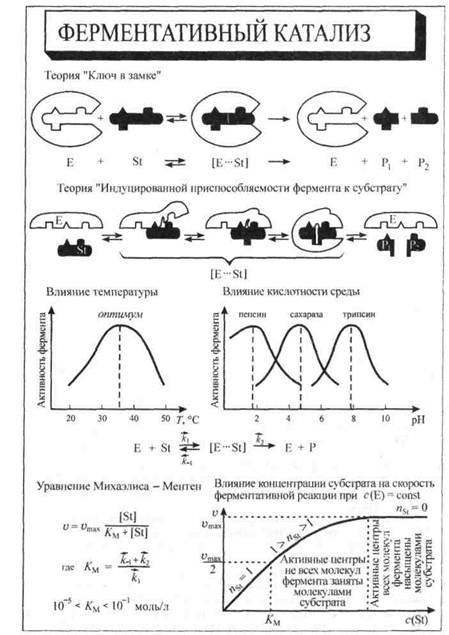
Высокая специфичность. Каждый фермент катализирует только определенную химическую реакцию. При этом некоторые ферменты практически полностью специфичны только для определенного субстрата и не оказывают каталитического действия на вещества, молекулы которых очень близки по строению молекуле субстрата. Например, фермент уреаза чрезвычайно эффективно катализирует гидролиз мочевины, но не катализирует гидролиз замещенных мочевин (например, N-метилмочевины). Для объяснения такой высокой специфичности используется теория ключ в замке. Согласно этой теории структура активного центра фермента является точным шаблоном структуры молекулы субстрата (табл. 5.1), который в результате взаимодействия с ферментом превращается в продукты реакции.
Другой случай представляют собой ферменты со сравнительно широкой специфичностью в отношении субстрата. Так, ферменты фосфатазы способны катализировать дефосфорилирование (отделение остатков фосфорной кислоты) широкого спектра фосфатов вне зависимости от их состава. Это объясняется теорией индуцированной приспособляемости фермента и субстрата. Согласно этой теории субстрат, взаимодействуя с аллостерическим центром фермента, вызывает изменение конформации фермента, и в то же время в молекуле субстрата также происходят некоторые необходимые изменения. В результате индуцированной приспособляемости фермента и субстрата формируется переходный комплекс фермент - субстрат, который в дальнейшем распадается на фермент и продукты реакции (табл. 5.1).
Вследствие высокой специфичности ферментов в обратимых процессах при определенных условиях они обычно увеличивают скорость только реакции, идущей в нужном направлении. В этом заключается одно из отличий ферментативного катализа от простого катализа.
Необходимость строго определенных условий. Ферменты проявляют наивысшую каталитическую эффективность при определенной температуре (36-38 °С) (табл. 5.1) и при определенном значении показателя кислотности среды рН (разд. 7.5). При температуре выше оптимальной начинается инактивация белковой молекулы вследствие изменения ее конформации, т. е. пространственной организации молекулы. При более низкой температуре протекание ферментативной реакции может затрудняться, например, из-за увеличения вязкости клеточных и межклеточных жидкостей.
Для каждой ферментативной реакции существует оптимальное значение рН среды, причем отклонение рН в любую сторону от этого значения приводит к резкому снижению активности. Зависимость ферментативной реакции от рН определяется кислотно-основными свойствами белковой молекулы, а также изменением ее конформации вследствие изменений в ионизации отдельных групп вблизи активного центра.
Влияние активаторов и ингибиторов. В организме для регуляции ферментативных процессов используются активаторы и ингибиторы. Активаторами ферментов часто бывают катионы металлов: Mg2+, Mn2+, Zn2+, Со2+, К+, а иногда - анион С1, которые, реагируя с ионизированными группами фермента, облегчают образование фермент-субстратного комплекса.
Важную роль в действии фермента играет аллостерическая регуляция его активности. В основе ее лежит взаимодействие фермента с молекулой определенного вещества, в результате изменяется структура фермента, что приводит к увеличению либо снижению каталитической активности фермента.
Ингибиторы тормозят действие ферментов, при этом следует различать обратимое и необратимое ингибирование фермента.
 |
Обратимое ингибирование ферментов наблюдается при взаимодействии с катионами металлов-токсикантов: H g2+, Pb2+, Cd2+, As3+ (разд. 10.5) или с ингибиторами белковой природы, которые за счет белок-белковых взаимодействий закрывают или инактивируют активный центр ферментов. При обратимом ингибировании ингибитор находится в равновесии с ферментом и его действие можно устранить с помощью антидотов или избытка субстрата.
При необратимом торможении ингибитор, обладающий структурным сходством с субстратом, блокирует активный центр фермента, надолго выводя его из строя. К таким веществам относятся многие инсектициды и отравляющие вещества.
В организме вместо инактивированных молекул фермента синтезируются новые молекулы. За счет этого организм реализует еще одну возможность регулирования хода ферментативных процессов. Особенности кинетики ферментативных реакции. Для каждой ферментативной реакции промежуточной стадией является присоединение к активному центру фермента (Е) молекулы субстрата (St) с возникновением фермент-субстратного комплекса ([ESt]), который в дальнейшем распадается на продукты реакции (Р) и молекулу фермента:
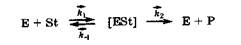
где 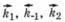 - константы скоростей отдельных стадий (в указанных стрелками направлениях).
- константы скоростей отдельных стадий (в указанных стрелками направлениях).
В этой цепи последовательно протекающих обратимых процессов лимитирующей (наиболее медленной) стадией является процесс распада фермент-субстратного комплекса на продукты реакции и фермент, а первая стадия обычно протекает сравнительно быстро, т. е. k1 > k2.
Образование фермент-субстратного комплекса приводит к перераспределению электронов в молекуле субстрата. Это в свою очередь уменьшает прочность разрываемых связей и, соответственно, приводит к значительному уменьшению энергии активации. Так, при некаталитическом разложении пероксида водорода Н2О2 величина Еа = 75 кДж/моль, а в присутствии каталазы энергия активации снижается до 7 кДж/моль, что приводит к увеличению константы скорости реакции в 4 • 1010 раз.
При данной концентрации фермента скорость реакции зависит от концентрации субстрата. Графически зависимость скорости реакции от концентрации субстрата представляет гиперболу (табл. 5.1). Причем при низких концентрациях субстрата реакция имеет по субстрату первый порядок (nst = 1), а при высоких - нулевой (nst = 0). При этом скорость реакции становится максимальной (vmах)- Достижение реакцией предельной скорости объясняется наличием в среде определенной концентрации фермента и тем, что все его активные центры оказываются занятыми. Эти обстоятельства приводят к тому, что последующий рост концентрации субстрата уже не вызывает изменения концентрации фермент-субстратного комплекса в системе. Поэтому максимальная скорость ферментативной реакции зависит от концентрации фермента в системе. Следует обратить внимание на то, что форма кинетической кривой ферментативной реакции подобна изотерме адсорбции (разд. 26.4.1).
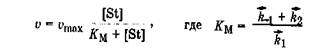 |
Впервые кинетическое описание ферментативных процессов сделали Л. Михаэлис и его сотрудница М. Ментен, которые предложили уравнение:
Км - константа Михаэлиса,учитывающая величины констант скоростей отдельных реакций (k1,k-1,k2), численно равна такой концентрации субстрата, при которой скорость ферментативной реакции равна половине максимальной (vmax/2) (табл. 5.1). Величина Kм для данной ферментативной реакции зависит от типа субстрата, рН реакционной среды, температуры и концентрации фермента в системе. В первом приближении реакция протекает тем быстрее, чем меньше Км.
Таким образом, механизм ферментативных реакций включает, по крайней мере, две стадии, а их скорость при данной температуре и кислотности среды зависит от концентрации и субстрата, и фермента, причем при заданной концентрации фермента скорость реакции достигает соответствующего предельного значения. Кроме того, на скорость ферментативных реакций влияет присутствие активаторов и ингибиторов данного фермента.
Дата публикования: 2014-10-16; Прочитано: 6839 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
