 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Смещение химического равновесия
|
|
Влияние изменения условий на химическое равновесие определяется принципом Ле Шателье.
Если на систему, находящуюся в состоянии химического равновесия, оказывать воздействие путем изменения концентрации реагентов, давления или температуры в системе, то равновесие всегда смещается в направлении той реакции, протекание которой ослабляет это воздействие.
Влияние концентрации реагентов. Увеличение концентрации исходных веществ вызывает смещение равновесия в сторону образования конечных продуктов. В то же время увеличение концентрации конечных продуктов вызывает смещение равновесия в сторону исходных веществ.
К этому же выводу можно прийти при анализе выражения для константы равновесия, учитывая, что ее величина не зависит от концентраций реагентов:
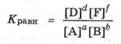
Таким образом, при изменении в равновесной системе концентрации любого из реагентов, или даже концентраций всех реагентов, исходное соотношение концентраций реагентов и величина Кравн в состоянии последующего равновесия не изменятся, хотя положение равновесия сместится в ту или иную сторону.
Влияние давления. Давление в системе изменяет концентрацию только газообразных веществ, что вызывает смещение равновесия. Повышение давления в системе смещает химическое равновесие в направлении реакции, идущей с образованием меньшего числа молей газообразных веществ, т. е. в сторону уменьшения объема, а понижение давления в системе вызывает сдвиг равновесия в противоположную сторону. При равном числе молей газообразных исходных и конечных продуктов изменение давления не смещает химическое равновесие. При изменении давления, как и при изменении концентрации реагентов, величина Kравн не изменяется.
Влияние температуры. Повышение температуры вызывает смещение равновесия в сторону эндотермической реакции ( Нр > > 0), а понижение температуры - в сторону экзотермической реакции (
Нр > > 0), а понижение температуры - в сторону экзотермической реакции ( Hр < 0). Изменение температуры прежде всего изменяет константы скоростей прямой и обратной реакции, причем в различной степени. Поэтому при изменении температуры изменяется константа равновесия и равновесный состав веществ в системе.
Hр < 0). Изменение температуры прежде всего изменяет константы скоростей прямой и обратной реакции, причем в различной степени. Поэтому при изменении температуры изменяется константа равновесия и равновесный состав веществ в системе.
Катализатор не вызывает смещения химического равновесия, а только ускоряет его наступление, как уже отмечалось (разд. 5.5).
Таким образом, за счет внешнего воздействия на систему, находящуюся в состоянии химического равновесия, можно вызвать его смещение. Однако равновесное состояние термодинамически устойчиво во времени, так как характеризуется минимумом энергии Гиббса.
Сложные биохимические процессы, протекающие в организме в соответствии с энергетическими и энтропийными факторами, обратимы и характеризуются соответствующими константами равновесия независимо от их природы: кислотно-основные, окислительно-восстановительные или комплексообразование. Для всех биологических жидкостей организма характерен определенный состав, который нельзя менять произвольно.
Законы наступления, сохранения и смещения динамического равновесия справедливы не только для химических и физико-химических процессов, но и имеют аналоги в живой природе. Так, аналогично принципу Ле Шателье в природе существует принцип адаптивных перестроек.
Любая живая система при воздействии на нее перестраивается так, чтобы уменьшить это воздействие.
Соблюдение этого принципа в живых системах позволяет им поддерживать состояние гомеостаза. Основу гомеостаза составляет стационарное состояние системы, причем далекое от равновесия, из-за чего живые системы способны к эволюции.
Многие обратимые биохимические процессы совершаются при участии биокатализаторов - ферментов. Эти вещества, ускоряя протекание реакций, резко сокращают время установления состояния равновесия, что чрезвычайно важно для организма.
Дата публикования: 2014-10-16; Прочитано: 3446 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
