 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Основные понятия и терминология раздела
|
|
Химические реакции разделяются на гомогенные и гетерогенные.
Гомогенные реакции характеризуются отсутствием поверхности раздела между реагентами, поэтому их взаимодействие протекает по всему объему системы.
При гомогенных реакциях реагирующие вещества находятся в одном агрегатном состоянии. Например:
а) реакции между газообразными веществами

б) реакции в растворах

Гетерогенные реакции характеризуются наличием поверхности раздела между реагентами, где и протекает их взаимодействие.
При гетерогенных реакциях реагирующие вещества находятся в разных агрегатных состояниях. Например:

Одним из основных параметров химических реакций является скорость, с которой они протекают.
Скорость химической реакции определяется изменением концентрации реагирующих веществ в единицу времени

Если измерять концентрации веществ в молях на литр, а время - в секундах, то единицей измерения скорости реакции будет моль/(л *с).
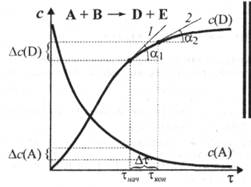
Так как в реакции могут принимать участие в качестве реагентов и продуктов несколько соединений, следует говорить не о скорости химического процесса вообще, а о скорости реакции по какому-либо одному компоненту (Xj). Кинетическая кривая, отражающая изменение концентрации какого-либо вещества во времени с(Хl) = f(т) в ходе химической реакции, имеет разный вид для реагента и продукта реакции (рис. 5.1). Кинетическая кривая дает информацию об истинной (мгновенной) скорости реакции в каждый момент времени. Истинная скорость реакции в данный момент времени (тнач, ткон) определяется на графике как тангенс угла наклона соответствующей касательной (1, 2) к оси времени.
Истинная скорость химической реакции характеризует скорость в данный момент времени ( —> 0)
—> 0)

 |
Как видно из рис. 5.1, касательные 1 и 2 характеризуются разными углами наклона a1 и a2, что свидетельствует об изменении скорости химической реакции по мере ее протекания. Поэтому наряду с истинной скоростью для характеристики химического процесса используют также среднюю скорость.
 |
Средняя скорость химической реакции по данному компоненту является усредненной скоростью за данный промежуток времени
Рис. 5.1. Кинетические кривые по реагенту (А) и продукту (D) приведенной ре акции
Средняя скорость химической реакции - величина приближенная. Истинная скорость является более объективной характеристикой реакции, но и она неудобна для сравнения скоростей различных реакций между собой вследствие ее изменяемости во времени. Поэтому ни истинная, ни средняя скорости реакции не используются в качестве ее кинетических характеристик; такой величиной является константа скорости реакции (разд. 5.2.2).
Каждая химическая реакция протекает по определенному механизму. Механизм реакции описывает ее путь, т. е. последовательность элементарных актов взаимодействия реагентов, через которые она протекает. Реакции, по их механизму, подразделяются на простые и сложные.
Простые, или элементарные, реакции — это реакции, протекающие в одну стадию.
Для таких реакций химическое уравнение полностью отражает, какие частицы и в каких соотношениях непосредственно участвуют в элементарном акте реакции. Например:

Большинство химических и все биохимические реакции являются сложными.
Сложные реакции - это реакции, протекающие в несколько стадий, каждая из которых является простой реакцией.
Например, реакция H2 + CI2 = 2НС1 является сложной. Обнаружено, что она протекает через множество стадий (разд. 5.4).
 |
Для сложных реакций общее химическое уравнение отражает только количественную характеристику процесса в целом и не учитывает, какие частицы и в каких соотношениях участвуют в отдельных стадиях процесса. Стадии сложных реакций могут протекать:
В соответствии с этим сложные реакции подразделяются на последовательные, параллельные, последовательно-параллельные и циклические. Большинство биохимических реакций являются последовательно-параллельными или циклическими многостадийными процессами (разд. 19.4).
В сложных реакциях скорости отдельных стадий могут резко отличаться друг от друга. В этих случаях скорость сложной реакции в целом будет определяться скоростью наиболее медленной стадии, называемой скоростьопределяющей или лимитирующей стадией. Поэтому при изучении механизма реакции по кинетическим данным прежде всего определяют кинетические характеристики ее лимитирующей стадии.
Дата публикования: 2014-10-16; Прочитано: 1890 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
