 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Второй закон термодинамики. Энергия Гиббса
|
|
Второй закон (второе начало) термодинамики определяет направленность и пределы протекания самопроизвольных процессов, в том числе и биохимических. Сначала рассмотрим изолированную систему, где исключен обмен энергией и веществом. Допустим, что в изолированной системе находятся два любых газа, например гелий и аргон, которые не взаимодействуют между собой и не перемешаны. Естественно, эти два газа будут самопроизвольно и необратимо смешиваться, а все свойства системы останутся без изменения, за исключением ее энтропии. В исходном состоянии системы, когда газы еще не смешались, ее энтропия SHaч меньше, чем энтропия SK0H состояния после смешивания газов, характеризующегося неупорядоченностью расположения и движения молекул газов. Следовательно, в результате самопроизвольного необратимого процесса в изолированной системе ее энтропия возросла: AS - SK0H - SHaч > 0. На основе этого сформулирован второй закон термодинамики для изолированных систем.
В изолированных системах самопроизвольно могут совершаться только такие необратимые процессы, при которых энтропия системы возрастает, т. е.  S > 0.
S > 0.
Для неизолированных систем нужно учитывать не только изменение энтропии, но и изменение энергии. Поэтому необходимо рассматривать две тенденции, определяющие направление самопроизвольно протекающих процессов:
1) стремление системы к достижению минимума энергии;
2) стремление системы к максимуму энтропии, т. е. к неупорядоченности.
Все процессы, при которых энергия в системе уменьшается, а энтропия возрастает, протекают самопроизвольно. Самопроизвольность других процессов зависит от того, какая из этих двух тенденций - энергетическая или энтропийная - окажется более эффективной, какая из этих противоборствующих тенденций получит перевес над другой. В этом проявляется противоречивость материального мира.
Для однозначной формулировки условие протекания самопроизвольных процессов в любых системах необходимо ввести еще одну термодинамическую функцию, которая характеризовала бы одновременно и энергетику, и неупорядоченность данных систем. Впервые такую термодинамическую функцию ввел Д. У. Гиббс, и в память об этом выдающемся американском ученом ее назвали энергией Гиббса.
Энергия Гиббса. Биохимические реакции обычно происходят при изобарно-изотермических условиях. В этих условиях энергетическое состояние системы характеризуется энтальпией, а мерой неупорядоченности системы будет произведение ее энтропии и температуры. Функцией, учитывающей обе эти характеристики и противоположность в тенденции их изменения при самопроизвольных процессах, является энергия Гиббса G:
 |
Энергия Гиббса являетсяобобщенной термодинамической функцией состояния системы, учитывающей энергетику и неупорядоченность системы при изобарно-изотермических условиях.
Энергию Гиббса называют также изобарно-изотермическим потенциалом или свободной энергией.
Подобно другим термодинамическим параметрам и функциям, характеризующим состояние системы, изменение энергии Гиббса в результате любого процесса определяется только конечным и начальным состоянием системы, независимо от пути процесса:
Для полной энергетической
 |
характеристики вещества при стандартных условиях используют стандартную энергию Гиббса образования вещества
 G0, значение которой дано в справочной литературе. Для простых веществ в термодинамически устойчивой форме стандартная энергия Гиббса их образования условно принята равной нулю.
G0, значение которой дано в справочной литературе. Для простых веществ в термодинамически устойчивой форме стандартная энергия Гиббса их образования условно принята равной нулю.
Изменение энергии Гиббса в результате химической реакции при стандартных условиях вычисляют по уравнению:

где  - стандартные энергии Гиббса продуктов реакции Yj и исходных веществ Хl;Vj; и v - соответствующие стехиометриче-ские коэффициенты в уравнении химической реакции.
- стандартные энергии Гиббса продуктов реакции Yj и исходных веществ Хl;Vj; и v - соответствующие стехиометриче-ские коэффициенты в уравнении химической реакции.
Изменение энергии Гиббса для биохимических процессов в условиях, отличных от стандартных, можно рассчитать на основе экспериментальных значений АН и AS для этих процессов по уравнению:
 |
где
 Н - характеризует полное изменение энергии системы при р, Т = = const и отражает стремление системы к минимуму энергии; TAS -характеризует ту часть энергии, которую нельзя превратить в работу, и отражает стремление системы к максимуму неупорядоченности;
Н - характеризует полное изменение энергии системы при р, Т = = const и отражает стремление системы к минимуму энергии; TAS -характеризует ту часть энергии, которую нельзя превратить в работу, и отражает стремление системы к максимуму неупорядоченности;  G -характеризует ту часть энергии, которую можно превратить в работу, и является термодинамическим критерием возможности самопроизвольного протекания любых процессов при р, Т = const.
G -характеризует ту часть энергии, которую можно превратить в работу, и является термодинамическим критерием возможности самопроизвольного протекания любых процессов при р, Т = const.
Соотношение между изменениями важнейших термодинамических параметров и функций, описывающими химические и биохимические процессы при р, Т = const, представлено на схеме и в табл. 4.1.
 |
Второй закон термодинамики для любых систем формулируется следующим образом:
В системе при постоянной температуре и давлении самопроизвольно могут совершаться только такие процессы, в результате которых энергия Гиббса уменьшается, т. е.  GKOH <
GKOH <  GHaч, или
GHaч, или  G < 0.
G < 0.
Таким образом, в соответствии со вторым законом термодинамики самопроизвольно ( Gp < 0) протекают все экзотермические реакции (
Gp < 0) протекают все экзотермические реакции (  Нр < 0) при любой температуре, если они сопровождаются увеличением энтропии (
Нр < 0) при любой температуре, если они сопровождаются увеличением энтропии ( Sp > 0). Эндотермические реакции (
Sp > 0). Эндотермические реакции (  HV > 0), сопровождающиеся уменьшением энтропии (
HV > 0), сопровождающиеся уменьшением энтропии ( Sp < 0), не могут протекать самопроизвольно при любой температуре, так как в этих случаях
Sp < 0), не могут протекать самопроизвольно при любой температуре, так как в этих случаях  Gp > 0.
Gp > 0.
 |
Биохимические реакции, сопровождающиеся уменьшением энергии Гиббса (
 Gp < 0), называют экзэргоническими реакциями, они могут совершаться самопроизвольно. Если в течение экзэргонической реакции энергия Гиббса только понижается, как показано на рис. 4.1, то такая реакция протекает в данных условиях самопроизвольно и необратимо. Чем больше значение энергии Гиббса биохимической системы в начальном состоянии
Gp < 0), называют экзэргоническими реакциями, они могут совершаться самопроизвольно. Если в течение экзэргонической реакции энергия Гиббса только понижается, как показано на рис. 4.1, то такая реакция протекает в данных условиях самопроизвольно и необратимо. Чем больше значение энергии Гиббса биохимической системы в начальном состоянии
 |
Рис. 4.1. Изменение энергии Гиббса в закрытой системе в необратимых экзэргонических реакциях, совершаемых самопроизвольно (р, Т = const)
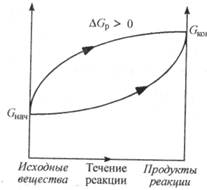 |
Рис. 4.2. Изменение энергии Гиббса в закрытой системе в необратимых эндэргонических реакциях (р, Т = const)
Gнач по сравнению с ее значением в конечном состоянии GKOH, тем больше химическое сродство между реагентами в рассматриваемой системе, т. е. их реакционная способность.
Критерий  Gp < О свидетельствует только о термодинамической возможности протекания данного процесса и ничего не говорит о скорости процесса и необходимых условиях для его начала. Например, горение графита С + О2 -> СO2 по законам термодинамики может происходить в стандартных условиях, так как
Gp < О свидетельствует только о термодинамической возможности протекания данного процесса и ничего не говорит о скорости процесса и необходимых условиях для его начала. Например, горение графита С + О2 -> СO2 по законам термодинамики может происходить в стандартных условиях, так как  Gp = -393,5 кДж/моль. Но графит при 298 К с кислородом не реагирует, а чтобы реакция пошла, необходимо создать определенные условия (запал, катализатор) для увеличения ее скорости.
Gp = -393,5 кДж/моль. Но графит при 298 К с кислородом не реагирует, а чтобы реакция пошла, необходимо создать определенные условия (запал, катализатор) для увеличения ее скорости.
Биохимические реакции, сопровождающиеся увеличением энергии Гиббса (рис. 4.2), называются эндэргоническими ( Gр > 0), и они невозможны без внешнего подвода энергии. Для того чтобы подобная реакция происходила, надо постоянно подводить энергию. Например, процесс фотосинтеза в растениях идет только под воздействием солнечной энергии:
Gр > 0), и они невозможны без внешнего подвода энергии. Для того чтобы подобная реакция происходила, надо постоянно подводить энергию. Например, процесс фотосинтеза в растениях идет только под воздействием солнечной энергии:

В живых системах эндэргонические реакции происходят за счет их сопряжения с экзэргоническими реакциями.
Дата публикования: 2014-10-16; Прочитано: 6768 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
