 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Понятие о г0ме0стазе
|
|
Главная особенность протекания обратимых биохимических реакций заключается в стремлении достичь динамического равновесия, так как это состояние возникает и поддерживается вследствие протекания реакций в двух пгютивоположных направлениях с одинаковыми скоростями  Такое состояние называется химическим равновесием, о котором подробно пойдет разговор дальше, а сейчас рассмотрим, как изменяется энергия Гиббса системы, в которой устанавливается химическое равновесие. В этом случае изменение энергии Гиббса в системе характеризуется наличием минимума, который соответствует состоянию химического равновесия (рис. 4.3, табл. 4.1). К этому равновесному состоянию возможен подход как со стороны исходных веществ
Такое состояние называется химическим равновесием, о котором подробно пойдет разговор дальше, а сейчас рассмотрим, как изменяется энергия Гиббса системы, в которой устанавливается химическое равновесие. В этом случае изменение энергии Гиббса в системе характеризуется наличием минимума, который соответствует состоянию химического равновесия (рис. 4.3, табл. 4.1). К этому равновесному состоянию возможен подход как со стороны исходных веществ 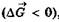 , так и со стороны продуктов реакции
, так и со стороны продуктов реакции

Таким образом, в случае протекания обратимых реакций
система самопроизвольно приходит к состоянию химического равновесия, из которого она без внешнего воздействия не может выйти, поскольку это требует увеличения энергии Гиббса.
 |
Рис. 4.3. Изменение энергии Гиббса в закрытой системе в обратимой химической ре акции (р, Т = const)
Химическое и биохимическое равновесное состояние системы характеризуется:
1) равенством скоростей прямой и обратной реакций  ;
;
2) энергетической выгодностью  ;
;
3) отсутствием изменений величин параметров и функций
состояния системы: концентрации реагентов  , энталь-
, энталь-
пии  , энтропиии
, энтропиии  энергии Гиббса
энергии Гиббса 
Поскольку в состоянии химического равновесия система достигает минимально возможного значения энергии Гиббса, то реакция, которая приводит в данных условиях к состоянию равновесия, всегда протекает самопроизвольно. Благодаря этой особенности обратимых процессов большинство биохимических реакций, протекающих в организме, обратимы.
Другая особенность биохимических процессов, протекающих в организме, заключается в их многостадийности, так как вероятность обратимого протекания отдельной стадии значительно выше, чем всего процесса в целом (рис. 4.4). Это объясняется тем, что разница между величинами Gнач и GK0H для каждой отдельной стадии обычно невелика (|  Gp| < 10 кДж/моль). Обратимость отдельных стадий биохимических процессов позволяет живому организму легко регулировать синтез тех или иных соединений в зависимости от потребности и тем самым поддерживать стационарное состояние.
Gp| < 10 кДж/моль). Обратимость отдельных стадий биохимических процессов позволяет живому организму легко регулировать синтез тех или иных соединений в зависимости от потребности и тем самым поддерживать стационарное состояние.
Стационарное состояние для живого организма характеризуется постоянством его термодинамических величин и неизменностью во времени скоростей поступления и удаления веществ и энергии. Несмотря на постоянство термодинамических величин, они не имеют равновесных значений в этом состоянии. Биологическое развитие организма возможно только в системе, находящейся в стационарном состоянии, но далеком от равновесия. Именно стационарное неравновесное состояние живой материи позволяет ей оптимизировать свои характеристики и эволюционировать во времени.
Термодинамическая особенность стационарного состояния открытых систем впервые сформулирована И. Р. Пригожиным (1946).
 |
Рис. 4.4. Изменение энергии Гиббса в многостадийном биохимическом процессе (р, Т = = const)
В открытой системе в стационарном состоянии прирост энтропии в единицу времени  принимает минимальное положительное значение для данных условий, т. е.
принимает минимальное положительное значение для данных условий, т. е.  -> min.
-> min.
Поскольку энтропия является мерой деградации, или рассеяния энергии, принцип Пригожина приводит к важнейшему заключению: при стационарном состоянии рассеяние энергии Гиббса открытой системой оказывается минимальным.
Термодинамические особенности открытых систем, характерные для живого организма, объясняют его устойчивость, позволяющую ему в течение многих лет сохранять определенный уровень работоспособности, а также относительное постоянство внутренней среды, называемое в биологии гомеостазом.
Гомеостаз — относительное динамическое постоянство состава и свойств внутренней среды организма, обуславливающее устойчивость его физиологических функций.
В формировании и поддержании состояния гомеостаза большую роль играет обратимость большинства биохимических процессов. Эти процессы всегда протекают самопроизвольно в направлении достижения равновесия, но, как правило, в организме они его не достигают, а только приводят к достижению необходимого соотношения между конечными и исходными продуктами реакции, протекающей самопроизвольно при данных условиях. Это происходит или за счет использования продуктов реакции, протекающей самопроизвольно, в других процессах, или за счет изменения условий в данной системе. Так, система, приближающаяся к химическому равновесию, переносится организмом в другие условия, при которых к состоянию химического равновесия приводит обратная реакция (разд. 5.5.1). Например, в легких, где концентрация кислорода большая, гемоглобин крови соединяется с кислородом (разд. 10.4), но, не достигнув состояния равновесия в насыщении кислородом, кровь переносится из легких к тканям, и там гемоглобин отдает кислород, поскольку при переходе от легких к тканям в крови изменяются условия для процесса взаимодействия гемоглобина с кислородом. Другой пример: формирование и рост костной ткани происходит в одних клетках - остеобластах, а ее растворение в других клетках - остеокластах (разд. 11.3), в то же время работа тех и других клеток регулируется организмом, что позволяет ему поддерживать содержание костной ткани на определенном уровне.
Таким образом, организм использует в своей жизнедеятельности обратимые биохимические процессы и их стремление к состоянию химического равновесия, но не допускает наступления устойчивого во времени химического равновесия, так как это состояние приведет к гибели организма. В то же время со стояние гомеостаза поддерживается за счет баланса, т. е. необходимого соотношения между компонентами с противоположными (антагонистическими) свойствами. Так, в основе гомеостаза организма находятся следующие химические и физико-химические балансы: кислотно-основный (гл. 8), окислительно-восстановительный (гл. 9), металло-лигандный (гл. 10), гидрофильно-липофильный (разд. 26.6), водно-электролитный (разд. 7.6). В современной литературе понятия "баланс" и "гомеостаз" часто используются как синонимы.
В заключение отметим основные положения, следующие из законов термодинамики:
- развитие системы происходит под влиянием двух тенденций - стремления к минимуму энергии и к максимуму энтропии;
- экзэргонические реакции в организме протекают самопроизвольно, так как  GP < 0;
GP < 0;
- эндэргонические реакции требуют подвода энергии, так как  GP > 0;
GP > 0;
- состояние равновесия в обратимых процессах с позиции
термодинамики характеризуется 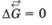 и является энергетически самым выгодным, так как
и является энергетически самым выгодным, так как  ;
;
- биологические системы в стационарном состоянии характеризуются  , а в соответствии с законом сохранения
, а в соответствии с законом сохранения
S + I = const для живых систем должна быть справедлива закономерность  (в пределах соблюдения приведенного
(в пределах соблюдения приведенного
закона сохранения). При этом биологические системы организма
далеки от состояния равновесия, что позволяет им оптимизировать свои характеристики и эволюционировать во времени.
 |
Общие законы биохимической термодинамики дают биологу, врачу и экологу ключ к пониманию энергетической стороны биохимических реакций в организме, процессов эмбриогенеза, регенерации и старения тканей, аналогичных процессов, протекающих в биосфере, а также дают возможность регулировать эти процессы осуществлением профилактических или исправляющих (лечебных) мероприятий.

Глава 5
Дата публикования: 2014-10-16; Прочитано: 3723 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
