 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
ЭНТРОПИЯ. Одним из важных аспектов термодинамики является формулировка условий самопроизвольности протекания любых процессов.
|
|
Одним из важных аспектов термодинамики является формулировка условий самопроизвольности протекания любых процессов.
Самопроизвольным, или спонтанным, является процесс, который совершается в системе без затраты работы извне и который уменьшает работоспособность системы после своего завершения.
Следовательно, самопроизвольно система может переходить только из менее устойчивого состояния в более устойчивое. На основе первого закона термодинамики можно сформулировать один из важных принципов самопроизвольности протекания процессов в системе, заключающийся в стремлении системы к минимуму энергии за счет выделения энергии в окружающую среду. Этот энергетический принцип особенно важен для простых систем, которые можно рассматривать как единую частицу. Например, капля дождя всегда самопроизвольно падает вниз, уменьшая при этом свою потенциальную энергию.
Эту каплю воды в то же время необходимо рассматривать как совокупность очень большого числа молекул, когда происходит процесс ее испарения, протекающий самопроизвольно, несмотря на то, что он эндотермический (требует поступления энергии из окружающей среды). Следовательно, для описания условий протекания самопроизвольных процессов одного энергетического принципа недостаточно, особенно в системах, состоящих из большого числа частиц. Главное изменение, которое происходит при испарении капли, заключается в переходе системы из жидкого состояния (с частично упорядоченным состоянием частиц) в парообразное, в котором частицы не упорядочены. Таким образом, для описания движения в системах, содержащих большое число частиц, необходимо учитывать неупорядоченность расположения и движения этих частиц, т. е. энтропию системы (разд. 4.1).
Значение энтропии системы как меры ее неупорядоченности зависит от агрегатного состояния и природы вещества, температуры, давления и сложности системы.
Энтропия вещества в газообразном состоянии больше, чем энтропия его в жидком состоянии, а последняя больше энтропии этого вещества в твердом состоянии:

Энтропия простых веществ зависит от их аллотропной формы:

Энтропия системы при повышении температуры возрастает, так как увеличивается неупорядоченность движения частиц:
если 
Энтропия системы при повышении давления уменьшается, так как снижается неупорядоченность движения частиц:
если 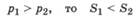
Энтропия системы с увеличением ее сложности повышается, так как возрастает число видов частиц и вариантов их расположения.
Для энергетической характеристики вещества при стандартных условиях, наряду со стандартной энтальпией, используют стандартную энтропию вещества S°. В отличие от стандартной энтальпии, стандартная энтропия простых веществ не равна нулю. Энтропия всех веществ всегда больше нуля.
В случае идеально упорядоченного кристалла при температуре О К его энтропия S = 0. Это дает естественную нулевую точку отсчета для значений энтропии (отсутствующую для ранее рассмотренных функций состояния U и Н) и позволяет измерить или теоретически рассчитать абсолютные значения энтропии. Поэтому перед символом энтропии вещества не ставят знак дельта (А). Значения энтропии для стандартных состояний веществ приведены в справочниках термодинамических величин.
Изменение стандартной энтропии в химической реакции  определяется разностью алгебраических сумм стандартных энтропии продуктов реакции Yj и исходных веществ Xi с учетом соответствующих стехиометиических коэффициентов:
определяется разностью алгебраических сумм стандартных энтропии продуктов реакции Yj и исходных веществ Xi с учетом соответствующих стехиометиических коэффициентов:

Дата публикования: 2014-10-16; Прочитано: 2031 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
