 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Взаимное влияние атомов. Электронные эффекты в органической химии
|
|
Ковалентная связь является неполярной, если связь осуществляется между атомами с одинаковой электроотрицательностью. При образовании связи между атомами с разной электроотрицательностью электронная плотность ковалентной связи смещена к более электроотрицательному атому. Такая связь полярна, при этом образуется диполь: на атомах, образующих связь, появляются заряды + d и - d, меньшие, чем заряд электрона. Эффект смещения электронной плотности вдоль s- связи называется индуктивным эффектом и обозначается I. Направление индуктивного эффекта заместителя определяется сравнением с атомом водорода, индуктивный эффект которого принят за О.(связь С - Н считают неполярной). Заместитель Х, притягивающий электронную плотность s - связи сильнее, чем атом водорода, проявляет отрицательный индуктивный эффект и обозначается -I. Если же заместитель Х увеличивает электронную плотность на атоме углерода, то он проявляет + I эффект, положительный индуктивный эффект. Графически индуктивный эффект обозначается стрелкой вдоль линии связи, острие которой направлено в сторону более электроотрицательного атома, а на p - связи обозначается изогнутой стрелкой, например:
 |
Индуктивный эффект быстро гаснет по цепи s - связей и считается, что его влияние на g - углеродный атом равно нулю:
 |
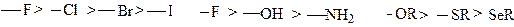 |
Большинство заместителей обладает – I эффектом и тем больше, чем выше электроотрицательность атома, связанного s - связью с атомом углерода. Заместитель тем сильнее притягивает электроны, чем правее и выше в периодической таблице находится элемент, определяющий его характер. Отсюда ясен следующий порядок изменения эффекта:
 |
Любая положительно заряженная группа имеет более сильный отрицательный индуктивный эффект, чем незаряженная, например:
Сильным отрицательным индуктивным эффектом обладают нитро-, сульфогруппы, связь в которых осуществляется по донорно - акцепторному механизму:
 |
Отрицательным индуктивным эффектом обладают p - связи, причем чем связь полярнее, тем больше этот эффект:
 |
 +I эффект проявляют металлы в металлоорганических соединениях:
+I эффект проявляют металлы в металлоорганических соединениях:
 |
+I эффектом обладают отрицательно заряженные группы (анионы):
 |
Алкильные группы обладают незначительным положительным индуктивным эффектом, причем эффект увеличивается с увеличением разветвления алкильного заместителя:
 |
Мезомерный эффект, или эффект сопряжения, проявляется в сопряженных системах, в соединениях, содержащих по крайней мере две кратные связи, разделенные простой связью, или кратную связь с заместителем, имеющим неподеленную электронную пару:
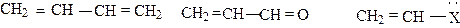 |
В случае проявления мезомерного эффекта происходит перекрывание p - или р - орбиталей заместителя с параллельными p - орбиталями кратных связей. С позиций теории МО мезомерный эффект - это отражение того факта, что атомные р-орбитали кратных связей могут перекрываться друг с другом, образуя новую орбиталь с более низкой энергией. Когда заместитель Х, имеющий неподеленную пару электронов или незанятую орбиталь, непосредственно связан с p - связью, то возникают такие же условия для перекрывания орбиталей с образованием единой сопряженной системы. Примером сопряженной системы является молекула бутадиена CH2 = CH – CH = CH2. Атомы углерода в этой молекуле находятся во втором валентном состоянии и, следовательно, имеют по одной р-орбитали, которые перекрываются не только у первого и второго, третьего и четвертого углеродных атомов, но вследствие пространственного положения также и у второго, и третьего углеродных атомов, образуя общее для всех четырех углеродных атомов p - электронное облако:
 |
Согласно вышесказанному, приведенная формула бутадиена не отражает истинного строения соединения. Связи между атомами имеют характер, промежуточный между двойной и ординарной (о чем говорят длины соответствующих связей, определенные физико - химическими методами). Такую молекулу более точно изображать формулой с парциальными связями:
 |
Как и индуктивному, мезомерному эффекту приписывают знак + (+ М) или – (- М). Заместителям, которые сдвигают р-электроны от двойной связи, приписывают - М эффект, а те, которые сдвигают электроны к двойной связи - + М - эффект. +M эффект проявляют отрицательно заряженные группы, причем чем меньше электроотрицательность атома,тем + М эффект больше:
 |
+М эффектом обладают заместители, имеющие неподеленную электронную пару, например:
 |
Для элементов разных периодов + М уменьшается с уменьшением электроотрицательности. Причина этого явления состоит в том, что только для 2р - орбиталей других атомов существуют наиболее благоприятные пространственные условия для перекрывания с 2р-орбиталью атома углерода.
-М эффект проявляется в сложных функциональных группах, содержащих полярные кратные связи:
-
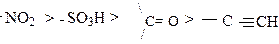 |
Мезомерный эффект заместителей обозначается:
1) стрелками, указывающими смещение p - или р-электронов:
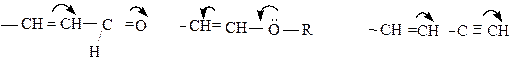 |
2) 2 с помощью парциальных связей между атомами, орбитали которых перекрываются
3) с помощью набора предельных структур (которые реально не существуют, но в совокупности описывают реальное состояние молекулы). Предельные структуры имеют одинаковое расположение атомов, одинаковое число электронов, но разные схемы их спаривания. Явление описания реальных структур с помощью резонансных структур называется мезомерией или резонансом. Предельные, резонансные структуры можно написать правильно путем последовательного изменения положения p - (или р) электронов в соответствии с направлением перемещения их, указанными стрелками. При написании резонансных структур необходимо учитывать, что при полном переносе электронной пары с одного атома к другому на соответствующих атомах должны появиться заряды + и -.
 |
4)
 |
Ни одна из предельных структур не существует реально, но вместе они отражают истинную картину строения соединения, в котором осуществляется взаимодействие p - и р - электронов. Эта картина приближенно может быть описана мезомерной формулой:
В отличие от индуктивного эффекта мезомерный эффект передается по цепи сопряженных связей без затухания:
 |
В целом, при оценке влияния заместителей на распределение электронной плотности в молекуле надо учитывать суммарное действие индуктивного и мезомерного эффектов. Все заместители в зависимости от того, повышают или понижают электронную плотность в молекуле, рассматриваются как электронодонорные или электроноакцепторные.
Таблица
Соотношение электронных эффектов заместителей.
| Заместитель | Электронные эффекты индуктивный мезомерный | Суммарное электронное влияние |
| Алкил | + I + М | Электронодонор |
| - O-, -NH- | + I + M | Электронодонор – |
| OH,OR,-NH2 | - I +M | Электронодонор +М > - I |
| NO2, SO3H, -COOH | -I -M | Электроноакцептор |
| NH3 + | -I | Электроноакцептор |
| Галогены | -I +M | Электроноакцептор-I> +M |
Дата публикования: 2014-10-25; Прочитано: 4339 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
