 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Донорно-акцепторные связи
|
|
Донорно-акцепторные связи.
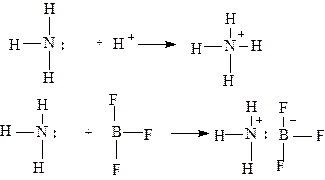 |
До сих мы считали, что при образовании ковалентной связи перекрываются две АО с одним электроном на каждой. Тем не менее можно представить молекулярную орбиталь, образованную за счет перекрывания одной заполненной орбитали и одной вакантной.
Одним из примеров такого образования связи является ион аммония.
Связь, образованная в результате показанных двух реакций, аналогична любой другой s - связи. Во второй реакции образование s - связи сопровождается возникновением противоположных по знаку зарядов на соседних атомах. Одновременно с образованием ковалентной связи за счет неподеленной пары электронов азота на связанных атомах возникают противоположные по знаку заряды. За счет электростатического притяжения между ними возникает дополнительно ионная связь. Результирующее сочетание ковалентной и ионной связи называется семиполярной связью.
Водородная связь. Водородная связь образуется между атомом водорода, соединенным с электроотрицательным атомом и атомом, имеющим неподеленную пару электронов. Водородная связь является разновидностью донорно - акцепторной связи. Графически водородная связь обозначается тремя точками. Например:
 |
Энергия водородной связи невелика (10 - 40 кДж / моль) и по своей природе является электростатической, тем не менее она в значительной степени влияет на физические и химические свойства соединений. Так, соединения с водородными связями имеют значительно более высокие температуры кипения, чем соединения с той же молекулярной массой, но не ассоциированные за счет водородных связей. Например, температура кипения этанола (78,30 C) значительно выше, чем температура кипения диметилового эфира (240С). Образованием водородных связей объясняют растворимость многих органических соединений в полярных растворителях. Так, в водном растворе происходит гидратация низших спиртов:
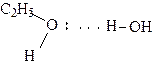 |
Разобранные выше примеры иллюстрируют случаи межмолекулярной водородной связи. Но могут возникать и внутримолекулярные водородные связи. Одним из таких примеров является большая летучесть о-салицилового альдегида (внутримолекулярная водородная связь) по сравнению с п – гидроксибензальдегидом (межмолекулярная водородная связь):
 |
Водородные связи играют большую роль в формировании пространственной структруры белков, углеводов, нуклеиновых кислот.
Дата публикования: 2014-10-25; Прочитано: 1547 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
