 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Полимеры флавоноидов
|
|
Полимеры флавоноидов - плохо изученная группа полимеров. Данные вещества, в основном, образуются при длительной выдержке вин. Сюда входят комплексы танид-антоциан (возникающие в результате реакций полимеризации и поликонденсации) [см. II часть “Химии вина”].
Вопросы для самоконтроля по теме:
1. Назовите роль фенольных веществ в формировании вина и цвета вина.
2. Какие вещества оказывают влияние на вкусовые качества вина?
3. В каких концентрациях содержатся фенольные вещества в красных и белых сортах винограда?
4. Каким образом классифицируются фенольные вещества?
5. Какие вещества являются красящими веществами винограда и вина?
6. Какие вещества относят к полимерам?
7. Какой компонент содержится в одеревеневших частях винограда и древесине дуба?
8. Технологическое значение фенольных веществ.
Тесты по теме:
1. К флавоноидам относятся:
А) Гирохиноны; Б) Терпеноиды; В) Флаванонолы; Г) Антоцианидины.
2. Разнообразные оттенки красного, розового и фиолетового цветов вину придают:
А) Катехины; Б) Антоцианы; В) Дигидрохалконы; Г) Ауроны.
3. При оклейке белковых помутнений используют:
А) Лигнин; Б) Меланины; В) Танин; Г) Катехины.
4. При выдержке вина в дубовых емкостях в вино переходит:
А) Катехины; Б) Лейкоантоцианы; В) Флавоны; Г) Лигнин.
5. Сколько бензойных колец входит в состав флавоноидов:
А) Одно; Б) Два; В) Три; Г) Четыре.
Глава 5. Ферменты
Ферменты - катализаторы биологической природы. Все ферменты являются белками. Они ускоряют скорость реакции в сотни - тысячи раз. Ферменты отличаются специфичностью, то есть каждый фермент катализирует строго определенную реакцию.
Наряду со строгой существует и групповая специфичность (например, ферменты подкласса эстераз катализируют группу реакций синтеза эфиров).
Так как ферменты - белки, то они очень чувствительны к изменению температуры. Для большинства ферментов оптимальной является температура в пределах 25¸37ОС. Наряду с термолабильными (или термочувствительными) существуют и термостабильные ферменты, к которым относятся многие гидролазы и пектинолитические ферменты, катализирующие процесс расщепления пектиновых веществ. Они стабильны при температуре в пределах 50¸80ОС. Ферменты также весьма чувствительны к изменению рН среды. В основном для ферментов оптимальным является рН=5¸9, но существует и исключение: протеолитические ферменты, катализирующие гидролиз белков, хорошо функционируют в кислой среде рН~1,5 (например, фермент пепсин, кислые протеазы).
Механизм действия ферментов, по современным предствалениям, заключается в образовании энзим-субстратного комплекса при взаимолействии фермента с субстратом; энзим-субстратный комплекс разрушается и образуется фермент и продукт реакции:
Е + S ® ES ® E + P,
где Е - фермент, S - субстрат, ES - энзим-субстратный комплекс, Р - продукты реакции.
При образовании энзим - субстратного комплекса ослабевают силы межмолекулярного взаимодействия в субстрате, снижается энергия активации, необходимая для протекания данной реакции, и увеличивается скорость протекания данной реакции.
Считается, что каждый фермент Е должен подходить к своему субстрату S:
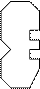 | 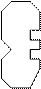 | ||||
 | |||||




 Е +
Е +
 |
S
ES-комплекс Е Р
При данном взаимодействии фермента и субстрата происходит перераспределение электронной плотности, ослабевают силы межмолекулярного взаимодействия в самом субстрате. В результате образуется продукт реакции и свободный фермент.
Участок в ферменте, где присоединяется субстрат, называется активным центром фермента. В активном центре многих ферментов находятся поливалентные катионы, способные менять свою валентность - катионы Fe+2, Fe+3, Cu+, Cu+2, Mg+2 и другие.
Существуют вещества, которые повышают активность самого фермента. Данные вещества называются активаторами. К ним относится цистеин, трипептид глютатион (с последовательностью гли-ала-глю). Также имеются вещества, которые снижают активность ферментов, вызывая ингибирование. Такие вещества называются ингибиторами. Среди них такие вещества, как кислоты (например, 3-хлоруксусная - белковый осадитель), фенольные вещества, соли циановодородной кислоты HCN, вещества, которые взаимодействуют с металлами активного центра фермента (осадители тяжелых металлов - сернистая кислота H2SO3, которая взаимодействует с солями меди и др. металлов).
Ингибиторы - довольно широкая группа веществ, вызывающих ингибирование, вплоть до инактивации фермента.
Активность ферментов в клетке регулируется связыванием их на различных структурах клетки.
Помимо активного центра в молекуле фермента присутствует аллостерическийцентр. К нему может присоединяться вещество, называемое эффектором. Присоединение эффектора к аллостерическому центру вызыввает изменение активности (чаще всего падение активности). Часто такими эффекторами служат промежуточные и конечные продукты реакции.
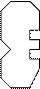
 |
Эффектор
Аллостерическое ингибирование встречается при спиртовом брожении, характерно для реакций образования побочных продуктов брожения [см. II часть “Химии вина”].
Следует отметить, что многие ферменты разделяются на фракции - изоферменты. Большинство ферментов носят название субстрата.
При созревании винограда в живой клетке действие ферментов локализовано. При этом существует определенная координация действия ферментов. При разрушении клетки винограда изменяется энтропия системы, поступает кислород воздуха и т.д., то есть происходят нерегулируемые биохимические превращения в клетке.
5.1. Классы ферментов
1. ОКСИДОРЕДУКТАЗЫ
катализируют окислительно-восстановительные реакции;
2. ТРАНСФЕРАЗЫ
катализируют реакции переноса;
3. ГИДРОЛАЗЫ
катализируют реакции гидролиза с участием воды;
4. ЛИАЗЫ
катализируют реакции негидролитического расщепления;
5. ИЗОМЕРАЗЫ
катализируют реакции изомеризации
6. СИНТЕТАЗЫ (ЛИГАЗЫ)
катализируют процессы синтеза с образованием или распадом соединений с макроэргической связью.
Наиболее изученными для винограда и вина являются ферменты классов оксидоредуктаз и гидролаз.
5.1.1. Оксидоредуктазы
Среди этого класса ферментов в винограде и вине обнаружены дегидрогеназы (ДГ) и оксидазы.
Дата публикования: 2014-11-02; Прочитано: 377 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
