 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Лабораторна робота 6
|
|
РОЗЧИНИ ЕЛЕКТРОЛІТІВ
Мета роботи: порівняти силу електролітів, дослідити, як проходять реакції обміну в розчинах електролітів.
Теоретичні відомості
Для слабких електролітів зміщення положення рівноваги дисоціації відповідає принципу Ле Шательє, на відміну від сильних електролітів, дисоціація яких у розчинах є практично необоротним процесом. Також цей принцип можна застосувати для рівноваги у насиченому розчині малорозчинного сильного електроліта.
Завдання для домашньої підготовки
Відхилення розчинів електролітів від законів Рауля. Ізотонічний коефіцієнт. Ступінь дисоціації електроліту та його зв’язок з ізотонічним коефіцієнтом і електричною провідністю розчину. Роль розчинника в процесі дисоціації. Сильні та слабкі електроліти. Стан сильних електролітів у розчинах. Поняття про активні концентрації та коефіцієнт активності. Константа дисоціації слабкого електроліту. Закон розведення. Ступінчаста дисоціація.
Рівновага в насиченому розчині малорозчинного електроліту. Добуток розчинності.
Йонні реакції в розчинах електролітів та умови їх перебігу до кінця.
Контрольні запитання та задачі
1. Розрахуйте ізотонічний коефіцієнт та уявний ступінь дисоціації електролітів (коефіцієнт активності), якщо:
а) розчин з молярною часткою гідроксиду натрію 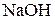 0,009 кристалізується при - 1,71
0,009 кристалізується при - 1,71 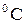 ;
;
б) в 2000 г води розчинено 5,3 г карбонату натрію 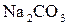 , розчин кристалізується при - 0,13
, розчин кристалізується при - 0,13 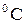 .
.
2. Розташуйте наведені речовини в порядку зростання температур кипіння їхніх розчинів з однаковою моляльною концентрацією, поясніть порядок розташування:
а) бромід калію  , хлорид магнію
, хлорид магнію 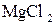 , бензойна кислота
, бензойна кислота  ;
;
б) сульфат алюмінію 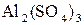 , гліцерин
, гліцерин 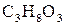 , нітрат калію
, нітрат калію 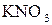 .
.
3. При зливанні розчинів яких речовин відбудуться реакції у розчині, чому? Запишіть рівняння відповідних реакцій у молекулярній та йонній формах:
а) хлорид кальцію 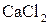 та карбонат натрію
та карбонат натрію 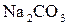 ;
;
б) сульфат купруму(ІІ) 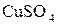 та сульфід натрію
та сульфід натрію  ;
;
в) хлорид натрію 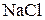 та нітратна кислота
та нітратна кислота  ;
;
г) сульфіт калію  та хлоридна кислота
та хлоридна кислота 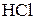 ;
;
д) нітрат плюмбуму 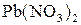 та хлорид магнію
та хлорид магнію 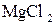 .
.
4. Ступені дисоціації ацетатної (оцтової) 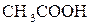 та фторидної
та фторидної  кислот дорівнюють, відповідно, 0,36 і 0,08, а їхні концентрації 10-4 та 10-1 моль/л. Яка з цих кислот є сильнішою, чому?
кислот дорівнюють, відповідно, 0,36 і 0,08, а їхні концентрації 10-4 та 10-1 моль/л. Яка з цих кислот є сильнішою, чому?
5. Наведіть рівняння ступінчастої дисоціації та вирази для ступінчастих констант дисоціації електролітів:
а)  ;
;
б) 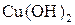 .
.
6. Виходячи з величини добутку розчинності (ДР), знайдіть розчинність у моль/л поданих далі солей:
а) бромід арґентуму  , ДР =
, ДР =  ;
;
б) хлорид плюмбуму  , ДР =
, ДР =  .
.
7*. Складіть рівняння реакцій у молекулярній та йонній формах:
1) 
2) 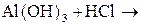
3) 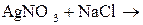
4) 
5) 
6) 
7) 
8) 
9) 
10) 
11) 
12) 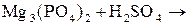
13) 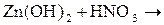
14) 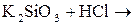
15) 
16) 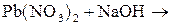
17) 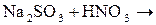
18) 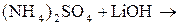
19) 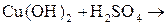
20) 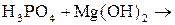
21) 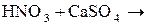
22) 
23) 
Дата публикования: 2014-11-04; Прочитано: 639 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
