 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Лабораторна робота 4
|
|
ХІМІЧНИЙ ЗВ’ЯЗОК. ВЛАСТИВОСТІ МОЛЕКУЛ. МІЖМОЛЕКУЛЯРНА ВЗАЄМОДІЯ
Мета роботи: вивчити механізм утворення ковалентного зв’язку за методом валентних зв’язків, механізм утворення йонного зв’язку.
Теоретичні відомості
Природа хімічного зв’язку суттєво впливає на властивості речовин. Метод валентних зв’язків дозволяє на якісному рівні пояснити просторову будову молекул.
3авдання для домашньої підготовки
Валентні електрони та валентності атомів у нормальному та збудженому станах. Суть ковалентного зв’язку. Двоцентровий двоелектронний зв’язок на прикладі молекули 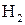 . Довжина та енергія ковалентного зв’язку.
. Довжина та енергія ковалентного зв’язку.
Основні положення методу валентних зв’язків (МВЗ). Насеність і напрямленість ковалентного зв’язку. Валентні кути в ковалентних молекулах. Гібридизація атомних орбіталей, типи гібридизації.
Приклади молекул з різними типами гібридизації атомних орбіталей.
s-, p-зв’язки. Делокалізований p-зв’язок.
Донорно-акцепторний механізм утворення ковалентного зв’язку.
Механізм утворення йонного зв’язку, його властивості: ненасиченість та ненапрямленість.
Полярність хімічного зв’язку. Ефективні заряди атомів та ступені окиснення. Залежність полярності зв’язку від електронегативності атомів.
Полярність молекул. Дипольний момент, його залежність від полярності зв’язку та просторової будови молекул. Здатність молекул до поляризації.
Міжмолекулярна взаємодія та її вплив на утворення конденсованого стану речовин. Орієнтаційна, індукційна та дисперсійна взаємодії, їх зв’язок з полярністю та здатністю молекул до поляризації.
Водневий зв’язок, його особливості. Міжмолекулярний та внутрішньомолекулярний водневий зв’язок, його вплив на властивості речовин.
Контрольні запитання та задачі
1. Використовуючи електронні схеми валентних підрівнів атомів:
а) флуору та хлору;
б) оксигену та сульфуру
поясніть, чому вони мають різні валентності, хоч і розташовані в одній підгрупі періодичної системи.
2. Що таке довжина зв’язку, від чого вона залежить? Наведіть приклади.
3. Що таке енергія зв’язку, від чого вона залежить? Наведіть приклади.
4. Визначте, які орбіталі атомів беруть участь в утворенні хімічних зв’язків у молекулах:
а) 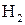 ;
;
б)  ;
;
в) 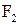 ;
;
г) 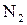 .
.
Наведіть схеми перекривання атомних орбіталей.
5. Наведіть електронні схеми центральних атомів, визначте наявність та тип гібридизації, наведіть схеми перекривання орбіталей в молекулах:
а) 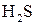 ;
;
б)  ;
;
в) 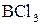 ;
;
г) 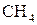 ;
;
д)  .
.
6. Поясніть, як утворюються хімічні зв’язки в молекулах:
а)  ;
;
б) 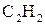 .
.
Відповідь дайте відповідно до наведеного нижче плану:
- електронна схема валентних підрівнів центрального атома,
- розподіл електронів між s- та p–зв’язками,
- тип гібридизації при утворенні s–зв’язків,
- схема перекривання атомних орбіталей при утворенні s- та p–зв’язків; зверніть увагу чи p-зв’язок є локалізованим, чи делокалізованим.
7. Використовуючи план відповіді попереднього питання, спробуйте передбачити тип гібридизації центрального атома та геометричну будову молекул:
а) 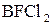 ;
;
б) 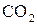 ;
;
в) 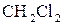 ;
;
г) 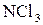 .
.
8. Поясніть, як утворюється хімічний зв’язок при взаємодії:
а) 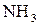 та
та 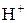 ;
;
б)  тa
тa 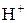 .
.
9 Поясніть, чому йонний зв’язок ненасичуваний та ненапрямлений (порівняти з ковалентним).
10. 3найдіть, використовуючи значення електронегативності, ступінь окиснення вказаного елемента в його сполуках:
а) оксигену в 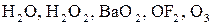 ;
;
б) карбону в 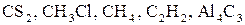 ;
;
в) нітрогену в 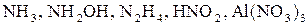 .
.
11. Поясніть, чи є полярними молекули, проаналізувавши їх будову та полярності окремих хімічних зв’язків:
а)  та
та 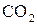 ;
;
б) 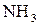 та
та 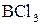 ;
;
в) 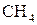 та
та  .
.
13. Для заданого ряду молекул поясніть, як і чому змінюється:
- полярність хімічних зв’язків, полярність молекул та значення дипольних моментів;
- здатність молекул до поляризації;
- енергія орієнтаційної взаємодії;
- енергія дисперсійної взаємодії.
Який з типів міжмолекулярної взаємодії переважає і чому?
а) 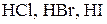 ;
;
б) 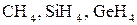 .
.
14. Поясніть, як виникає водневий зв’язок. Наведіть приклади речовин з водневим зв’язком.
Дата публикования: 2014-11-04; Прочитано: 331 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
