 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Лабораторна робота 5
|
|
ЗАГАЛЬНІ ВЛАСТИВОСТІ РОЗЧИНІВ
Мета роботи: навчитися визначати теплоту розчинення, теплоту гідратації, вивчити, як впливає зміна температури на розчинність різних речовин.
Теоретичні відомості
За міжнародною системою одиниць СІ рекомендується користуватися такими способами вираження концентрації розчинів (в дужках, у деяких випадках, наводяться колишні назви, які тепер рекомендуються не вживати):
1. Масова частка 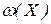 (масовий процент, процентна концентрація) визначається як відношення маси розчиненої речовини
(масовий процент, процентна концентрація) визначається як відношення маси розчиненої речовини 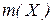 до загальної маси розчину
до загальної маси розчину 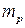 :
:
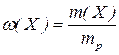 , або
, або 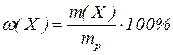


Якщо розчин складається з двох компонентів,  , де
, де 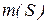 – маса розчинника.
– маса розчинника.
2. Молярна частка  – це відношення числа молів розчиненої речовини
– це відношення числа молів розчиненої речовини  до загального числа молів усіх речовин у розчині
до загального числа молів усіх речовин у розчині 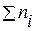 :
:
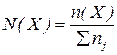 , або
, або 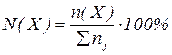

Наприклад, для двокомпонентної системи: 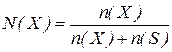 , де
, де  - число молів розчинника.
- число молів розчинника.
Масова частка та молярна частка – безрозмірні величини.
3. Молярна концентрація 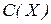 визначається як відношення числа молів розчиненої речовини
визначається як відношення числа молів розчиненої речовини  до об’єму розчину (розмірність моль/л, або моль/
до об’єму розчину (розмірність моль/л, або моль/ 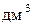 ):
):
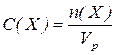
де 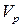 – об’єм розчину.
– об’єм розчину.
4. Моляльність (моляльна концентрація)  – число молів розчиненої речовини
– число молів розчиненої речовини  в 1 кг розчинника (розмірність моль/кг):
в 1 кг розчинника (розмірність моль/кг):
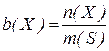
де 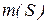 – маса розчинника.
– маса розчинника.
Якщо задані маси, об’єм або кількість молів розчиненої речовини та розчинника (чи розчину), для розрахунків концентрації використовуються наведені вище вирази, а також відомі співвідношення між масою та об’ємом речовин (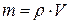 ) та між масою та кількістю речовини
) та між масою та кількістю речовини  .
.
Завдання для домашньої підготовки
Дисперсні системи. Типи розчинів. Істинні розчини. Розчинник та розчинена речовина. Способи вираження концентрації розчинів. Процеси, що протікають при розчиненні. Сольватація. Зміна ентальпії при розчиненні. Вплив природи речовин, тиску та температури на розчинність газів, рідин та твердих речовин у рідинах.
Зниження тиску насиченої пари, підвищення температури кипіння та зниження температури кристалізації розчинів (закони Рауля). Визначення молекулярних мас розчинених речовин.
Контрольні запитання та задачі
1. Для кожного з названих нижче розчинів:
а) 3,6 г хлориду натрію 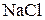 розчинено в 340 г води;
розчинено в 340 г води;
б) 4,45 г броміду калію  розчинено в 564 г етанолу
розчинено в 564 г етанолу  ;
;
в) 35,2 г етиленгліколю 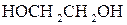 розчинено в 65 г води;
розчинено в 65 г води;
г) 2,4 г хлориду натрію 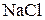 та 3,6 г броміду калію
та 3,6 г броміду калію  розчинено в 82 г води
розчинено в 82 г води
розрахуйте масову частку кожної розчиненої речовини, молярну частку кожного компонента, моляльність.
2. Молярна частка гідроксиду натрію 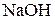 у водному розчині становить 0,25, густина розчину 1,49 г/см3. Розрахуйте масову частку гідроксиду натрію, його моляльну та молярну концентрації.
у водному розчині становить 0,25, густина розчину 1,49 г/см3. Розрахуйте масову частку гідроксиду натрію, його моляльну та молярну концентрації.
3. Які розчини називають істинними? Чим істинні розчини подібні до хімічних сполук, а чим - до сумішей?
4. Що таке сольватація? Які процеси відбуваються і які сили міжмолекулярної взаємодії діють при розчинені:
а) метанолу 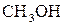 у воді;
у воді;
б) азоту в етанолі 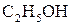 ;
;
в) нітрату калію у воді;
г) гексану 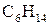 в бензолі
в бензолі 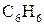 ?
?
5. Для процесу розчинення газів у рідинах поясніть:
- позитивне чи негативне значення має ентальпія розчинення;
- як і чому впливає тиск на розчинність газів у рідинах, сформулюйте закон Генрі.
6. Для процесу розчинення кристалічних речовин у рідинах поясніть, позитивне чи негативне значення найчастіше має ентальпія розчинення.
7. Наведіть формулювання І-го закону Рауля, його математичний вираз. Поясніть зміст величин, що входять до цього виразу. Наведіть графік, що ілюструє І-й закон Рауля.
8. Наведіть формулювання та математичний вираз ІІ-го закону Рауля для процесу кипіння розчинів нелетких неелектролітів у летких розчинниках. Як пов’язана зміна температури кипіння розчину із зміною тиску його насиченої пари (поясніть за допомогою відповідної графічної залежності)?
9. Наведіть формулювання та математичний вираз ІІ-го закону Рауля для процесу кристалізації розчинів нелетких неелектролітів у летких розчинниках. Як пов’язана зміна температури кристалізації розчину із зміною тиску його насиченої пари (поясніть за допомогою відповідної графічної залежності)?
10. Чому дорівнює зниження тиску насиченої пари над розчинами, які містять:
а) 18 г глюкози 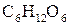 у 100 г води;
у 100 г води;
б) 12 г сечовини  у 200 г води.
у 200 г води.
Температура розчинів l00 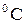 . Чому дорівнює тиск насиченої пари над розчинами за цих умов?
. Чому дорівнює тиск насиченої пари над розчинами за цих умов?
11. Розрахуйте температуру кипіння та температуру кристалізації розчину гліцерину 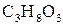 у воді, якщо масова частка гліцерину дорівнює
у воді, якщо масова частка гліцерину дорівнює
3 %. (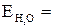 0,52 кг град/моль,
0,52 кг град/моль, 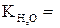 1,86 кг град/моль).
1,86 кг град/моль).
12. Розрахуйте масу етиленгліколю 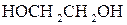 , який потрібно додати до 5 кг води, щоб приготувати розчин, що буде замерзати за
, який потрібно додати до 5 кг води, щоб приготувати розчин, що буде замерзати за
260,15 К. (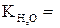 1,86 кг град/моль).
1,86 кг град/моль).
13. 3найдіть молекулярну масу речовини, якщо розчин, що містить 23 г цієї речовини в 200 г води, починає кипіти при 100,8 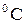 .
.
14. Поясніть, чи відрізняються температури кристалізації розчинів які містять у 2000 г води:
а) 0,5 моль цукру  та 0,5 моль глюкози
та 0,5 моль глюкози 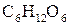 ;
;
б) 100 г цукру та 100 г глюкози.
Дата публикования: 2014-11-04; Прочитано: 566 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
