 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Лабораторна робота 8
|
|
ОКИСЛЮВАЛЬНО-ВІДНОВНІ ПРОЦЕСИ
Мета роботи: навчитися складати гальванічні елементи та вимірювати їх електрорушійну силу (ЕРС), навчитися користуватися електролізером та провести електроліз розчинів солей.
Теоретичні відомості
Гальванічний елемент – це електрохімічна система, в якій енергія хімічної реакції перетворюється в електричну енергію. Інший тип електрохімічної системи, в якій під час електролізу енергія електричного струму витрачається на протікання несамочинної хімічної реакції, називається електролізером. В обох типах електрохімічних систем процеси окиснення і відновлення розділені у просторі і перебігають в окремих частинах системи, що називаються електродами. Напрямок окислювально-відновної реакції та послідовність процесів на електродах визначається значеннями відповідних окислювально-відновних потенціалів.
Завдання для домашньої підготовки
Процеси окиснення та відновлення. Окисники та відновники. Електродний потенціал та його виникнення. Вплив умов на значення потенціалу. Стандартний електродний потенціал. Водневий електрод. Гальванічний елемент, його електрохімічна схема, процеси на електродах. Електрорушійна сила (ЕРС) гальванічного елементу.
Вимірювання стандартних електродних потенціалів. Залежність окислювальних та відновних властивостей від значень стандартних електродних потенціалів. Напрямленість окислювально-відновних процесів.
Електроліз. Послідовність розряду йонів на катоді та аноді. Закони електролізу.
Контрольні запитання та задачі
1. Складіть схему гальванічного елемента, який можна використати для вимірювання стандартного потенціалу електрода:
а) ртутного;
б) нікелевого;
в) цинкового.
Запишіть рівняння процесів, які протікають на електродах, сумарні рівняння реакцій, які відбуваються в гальванічному елементі, вкажітъ окисник та відновник, знайдіть значення ЕРС елемента.
2. Визначте потенціали водневого електрода:
а) у чистій воді;
б) у хлоридній кислоті 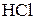 (С(
(С(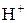 ) = 0,01 моль/л);
) = 0,01 моль/л);
в) у розчині гідроксиду натрію 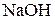 (С(
(С( ) = 0,01 моль/л).
) = 0,01 моль/л).
3. За значеннями окислювально-відновних потенціалів визначте, чи підуть самочинно реакції:
а) 
б) 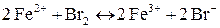
в) 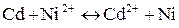
г) 
д) 
е) 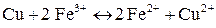
4. Які процеси відбуваються при електролізі:
а) водного розчину сульфату нікелю 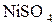 з інертним анодом;
з інертним анодом;
б) водного розчину сульфату нікелю 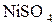 з нікелевим анодом;
з нікелевим анодом;
в) водного розчину нітрату натрію 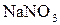 з інертним анодом;
з інертним анодом;
г) розплаву та водного розчину броміду натрію  з інертним анодом;
з інертним анодом;
д) водного розчину нітрату арґентуму 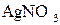 з інертним анодом;
з інертним анодом;
е) водного розчину нітрату арґентуму 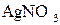 з срібним анодом.
з срібним анодом.
Дата публикования: 2014-11-04; Прочитано: 413 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
