 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Будова атома
|
|
Мета роботи: навчитися складати електронні формули та схеми атомів елементів.
Теоретичні відомості
Рух електронів у навколоядерному просторі описується законами квантової механіки. Знаючи елементи теорії квантової механіки, інтервали значень квантових чисел (n - головне, визначає повну енергію електрона; l – орбітальне, визначає форму орбіта лі (рис.3); m – магнітне, визначає розподіл орбіта лей у просторі;  - спінове, спрощено передають як обертання електрона навколо власної осі), можна охарактеризувати будову електронної оболонки атомів за допомогою електронних формул та схем.
- спінове, спрощено передають як обертання електрона навколо власної осі), можна охарактеризувати будову електронної оболонки атомів за допомогою електронних формул та схем.

Рис.3. Форми орбіталей.
Завдання для домашньої підготовки
Атом. Абсолютні маси атомів. Електрон, його маса, заряд, спін. Теорія Резерфорда. Складові частини атома: ядро та електронна оболонка. Квантовий характер випромінювання і поглинання енергії. Рівняння Планка. Теорія будови атома гідрогену Бора. Спектр атома гідрогену як експериментальне підтвердження теорії Бора.
Хвильові властивості електрона. Рівняння де Бройля. Поняття про квантову механіку. Рівняння Шредінгера для стаціонарних станів. Хвильова функція та її властивості. Фізичний зміст  . Електронна хмарина, орбіталі. Квантові числа: головне, орбітальне, магнітне, спінове. Їх фізичний зміст та межі значень. Енергетичні рівні та підрівні. Форми s-, p-, d- та f-орбіталей.
. Електронна хмарина, орбіталі. Квантові числа: головне, орбітальне, магнітне, спінове. Їх фізичний зміст та межі значень. Енергетичні рівні та підрівні. Форми s-, p-, d- та f-орбіталей.
Принцип Паулі. Характеристика електронів в атомі за допомогою чотирьох квантових чисел. Правило Гунда. Послідовність заповнення електронами енергетичних підрівнів. Принцип найменшої енергії. Електронні формули та електронні схеми атомів.
Контрольні запитання та задачі
1. Сформулюйте 1-й постулат Бора та наведіть його математичний вираз.
2. Наведіть рівняння де Бройля та поясніть його суть.
3. Використовуючи формулу, яка показує залежність енергії електрона від головного квантового числа для атома гідрогену, поясніть:
а) на якому рівні – I чи II – електрон має більшу енергію?
б) у якому випадку виділяється квант з більшою енергією: при переході електрона з II рівня на I чи з III на II?
Відповідь підтвердіть відповідними розрахунками.
4. Поясніть, чи існують підрівні:
а) 1s, 2р, 2f, 3d;
б) 1d, 2s, 3f, 4p.
Відповідь обгрунтуйте, вказавши значення n та l для відповідних підрівнів.
5. Яке квантове число визначає форму орбіталей? Наведіть приклади.
6. Покажіть за допомогою схем, як розташовані електрони:
а) на d-підpiвні, якщо S  = 0, 1 та 2;
= 0, 1 та 2;
б) на р-підрівні, якщо S  = 0 та 1.
= 0 та 1.
7. Яким набором квантових чисел характеризується кожна орбіталь та кожний електрон таких підрівнів:
а) 4  ;
;
б) 3  ;
;
в) 4  .
.
Відповідь наведіть у вигляді таблиць:
| Орбіталі | Електрони | ||||||||
| № | n | l | m | № | n | l | m | 
| |
8. Поясніть, використовуючи принцип Паулі та значення квантових чисел, яка максимальна кількість електронів може знаходитись:
а) на р-підрівні;
б) на d-підрівні;
в) на f-підрівні.
9. Наведіть електронні формули та схеми атомів елементів, що мають порядкові номери:
а) 15, 22, 31;
б) 13, 26, 33;
в) 23, 34, 40.
Для останнього елемента пояснітьпослідовність заповнення підрівнів.
Лабораторна робота 3
ПЕРІОДИЧНИЙ ЗАКОН
Мета роботи: навчитись знаходити місце елементу в періодичній системі, виходячи з будови валентних підрівнів атомів елементів.
Теоретичні відомості
Періодичний закон та періодична система елементів тісно пов’язані з періодичним характером зміни будови валентних підрівнів атомів і дозволяє пояснити характер зміни хімічних властивостей елементів в залежності від зарядів атомних ядер.
Завдання для домашньої підготовки
Періодичний закон Д. І. Менделєєва, його формулювання. Періодичні та неперіодичні властивості елементів. Періодична система як втілення періодичного закону. Структура періодичного закону: періоди, групи, підгрупи. Номер групи та валентність елементів.
Зміна властивостей елементів у періоді, групі. Місце елемента в періодичній системі як його найважливіша характеристика. Передбачення властивостей невідомих елементів за допомогою періодичного закону. Загальнонаукове значення періодичного закону.
Закон Мозлі. Сучасне формулювання періодичного закону. Періодична система та її зв’язок з будовою атома. Номер періоду, його фізичний зміст Заповнення електронами підрівнів у кожному періоді. Кількість елементів в періоді: s-, p-, d- та f-елементи.
Особливості електронної будови атомів у головних та в побічних підгрупах. “Проскок” електрона. Номер групи та його фізичний зміст.
f-елементи, особливості їх електронної будови та положення в періодичній системі.
Радіуси атомів, їх зміна в періодах, групах.
Енергія іонізації, її зміна в періодах та групах. Енергія спорідненості до електрона, її залежність від електронної будови атома. Електронегативність. Значення електронегативності для характеристики хімічних властивостей елементів та типу хімічного зв’язку.
Контрольні запитання та задачі
1. Наведіть формулювання періодичного закону за Д. І. Менделєєвим. У чому воно не узгоджується зі структурою періодичної таблиці?
2. Що таке ізотопи? Поясніть, чи узгоджується початкове формулювання періодичного закону з існуванням ізотопів.
3. Сформулюйте закон Мозлі, наведіть його математичний вираз, поясніть зміст величин, що до нього входять.
4. Як пояснити суть закону Мозлі з позицій теорії будови атома, чому відкриття закону Мозлі призвело до зміни формулювання періодичного закону?
5. Наведіть сучасне формулювання періодичного закону, поясніть у чому його перевага у порівнянні з початковим.
6. Як пояснити, чому в заданих далі періодах міститься різне число елементів:
а) у першому та другому;
б) у третьому та четвертому.
7. Які підрівні заповнюються у атомів елементів:
а) чeтвepтoгo;
б) п’ятого;
в) шостого періодів?
Поясніть, у яких елементів цього періоду заповнюються s-, р-, d- чи f- підрівні, скільки та які елементи (s, p, d, f) належать до головних та побічних підгруп.
8. Поясніть особливості розташування в періодичній таблиці
f-елементів.
9. Наведені закінчення електронних формул атомів елементів:
а) 2 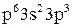 ;
;
б)  ;
;
в) 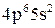 ;
;
г) 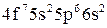 .
.
Підкресліть валентні підрівні атомів елементів, поясніть, в якій групі, підгрупі, періоді знаходяться ці елементи.
10. Наведіть електронні формули атомів елементів, що мають порядковий номер:
а) 21;
б) 32;
в) 41;
г) 91;
д) 48;
е) 79;
ж) 61.
3найдіть валентні електрони, поясніть, виходячи з будови електронних оболонок атомів, у якому періоді, групі, підгрупі знаходяться ці елементи.
11. Поясніть, як і чому змінюється енергія іонізації у елементів другого періоду. Чи є її зміна монотонною? Чому?
12. Що таке енергія спорідненості до електрона? У яких елементів другого періоду вона найбільша, у яких набуває від’ємних значень, чому?
13. Що таке електронегативність, як вона визначається, з якими властивостями елементів вона пов’язана?
14. Наведіть приклади елементів, у яких спостерігається “проскок” електрона. Чому він виникає?
15*. Який інертний газ та йони яких елементів мають однакову електронну конфігурацію з частинкою, що утворюється в результаті видалення з атома фосфору всіх валентних електронів?
16*. Чи можуть електрони йона  перебувати на таких підрівнях:
перебувати на таких підрівнях:
а) 3s;
б) 2d;
в) 4p.
Дата публикования: 2014-11-04; Прочитано: 1574 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
