 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Експериментальна частина. Визначення молярної маси еквівалентів металу
|
|
Визначення молярної маси еквівалентів металу
Молярну масу еквівалентів цинку потрібно визначити об’ємним методом за результатами дослідження взаємодії цинку з хлоридною кислотою:

У колбу місткістю 250 мл налийте через лійку 20 мл розчину хлориднoї кислоти так, щоб кислота не попала зсередини на шийку колби. Потім колбу потрібно закріпити горизонтально (див. малюнок). У шийку колби покладіть шматочок цинку, попередньо зважений з точністю до 0,01 г. Отвір колби щільно закрийте газовідвідною трубкою, протилежний кінець якої занурте у кpиcталiзатор з водою.
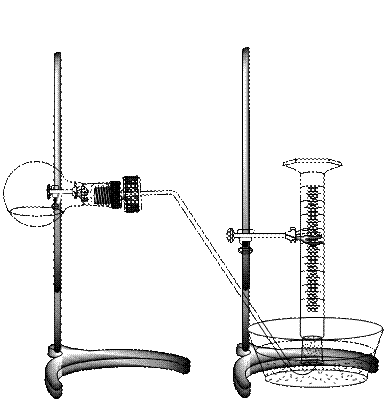
Рис.1 Прилад для визначення молярної маси еквівалентів металу
Прилад (рис.1) потрібно перевірити на герметичність. Для цього нагрійте рукою верхню частину колби. Якщо прилад герметичний, з трубки будуть виділятися бульбашки повітря. Якщо бульбашки не виділяються, то необхідно перевірити всі місця з’єднання. Потім окремо заповніть мірний циліндр міcткіcтю 250 мл водою та закрийте скляною пластинкою так, щоб у циліндрі не було бульбашок повітря. Опустіть циліндр у кристалізатор з водою отвором донизу і під водою заберіть пластинку, закріпіть циліндр у штативі вертикально.
Кінець газовідвідної трубки підведіть під циліндр (див. рис. 1) і переведіть колбу у вертикальне положення. Потрапивши на дно колби, шматочок цинку починає взаємодіяти з кислотою. Водень, що виділяється, буде збиратися в циліндрі над водою, витісняючи її. Після розчинення цинку слід виміряти об’єм водню, що виділився, та висоту водяного стовпа від поверхні води в кристалізаторі до поверхні води у циліндрі.
Дані досліду занесіть до лабораторного журналу:
1. Маса наважки металу 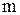 , г
, г
2. Об’єм водню в циліндрі 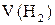 , мл
, мл
3. Висота водяного стовпа 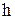 , мм
, мм
4. Барометричний тиск 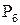 , мм рт. ст.
, мм рт. ст.
5. Температура 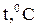
6. Тиск водяної пари, що насичує простір при температурі досліду
(з таблиці) 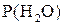 , мм рт.ст.
, мм рт.ст.
Тиск водню в циліндрі 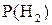 визначте із співвідношення:
визначте із співвідношення:

розрахуйте масу водню за рівнянням Менделєєва-Клапейрона:

при цьому значення 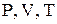 треба спочатку перевести в систему СІ
треба спочатку перевести в систему СІ
(1мм рт.ст. = 133,12 Па, 1мл =  ; R = 8,31 Дж/(моль К)).
; R = 8,31 Дж/(моль К)).
Молярну масу еквівалентів цинку розрахуйте, користуючись законом еквівалентів:
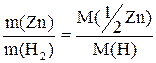
Визначте абсолютну  та відносну
та відносну 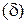 похибки досліду:
похибки досліду:
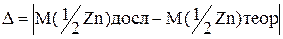 ;
;
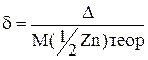
Визначення молярної маси вуглекислого газу.
Суху колбу місткістю 250 мл закрийте корком. Олівцем на склі позначте рівень, до якого корок уходить у шийку колби. Зважте закриту корком колбу на технохімічних терезах із точністю до 0,01 г. Заповніть колбу вуглекислим газом з апарата Кіппа (рис.2). Повноту заповнення перевірте тліючою скибкою. Закрийте колбу корком так, щоб він зайняв попереднє положення. Зважте колбу з вуглекислим газом.
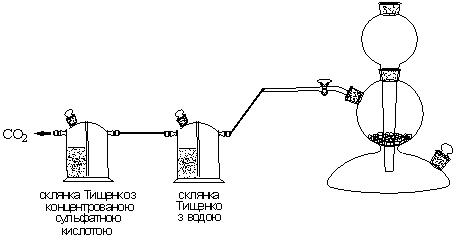
Рис.2. Одержання, очищення та сушіння вуглекислого газу.
Повторіть наповнення колби вуглекислим газом і знову зважте її. Розбіжність між масами не має перевищувати похибки зважування (0,01 г). Якщо різниця більша за це значення, потрібно повторити наповнення колби вуглекислим газом та зважування.
Налийте в колбу води до позначки та визначите її об’єм, вимірявши його мірним циліндром. Об’єм колби дорівнює об’єму повітря та об’єму вуглекислого газу, яким наповнювали колбу.
Дані досліду занесіть до лабораторного журналу:
1. Маса колби з повітрям 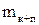 , г
, г
2. Маса колби з вуглекислим газом  , г
, г
3. Об’єм колби 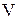 , мл
, мл
4. Температура 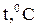
5. Барометричний тиск 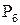 , мм рт. ст.
, мм рт. ст.
Перерахуйте об’єм повітря (вуглекислого газу) на н.у.:

Знайдіть кількість речовини повітря у колбі:
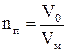
Розрахуйте масу повітря 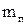 у колбі:
у колбі:
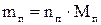 ,
,
де  =29 г/моль – молярна маса повітря.
=29 г/моль – молярна маса повітря.
Знайдіть масу колби:
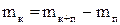
та масу вуглекислого газу:
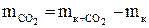
Розрахуйте молярну масу вуглекислого газу 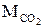 трьома способами:
трьома способами:
1. за кількістю речовини вуглекислого газу в колбі:
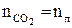 ;
; 
2. за відносною густиною за повітрям:
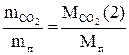
3. за рівнянням Менделєєва-Клапейрона:
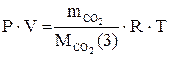
Визначте середнє значення молярної маси:
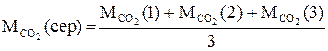
Визначте абсолютну  та відносну
та відносну 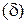 похибки досліду:
похибки досліду:
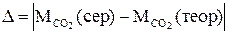 ;
;

Дата публикования: 2014-11-04; Прочитано: 768 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
